V podzemí Stredoeurópskeho technologického inštitútu Masarykovej univerzity v Brne čierna oceľová škatuľa vysoká tri metre a drahšia ako päť áut Bugatti Veyron (8 miliónov eur) pumpuje terabity fotiek zmrazených vírusov a proteínov na úložné disky. Veľký čierny obal vnútri ukrýva jeden z najvyspelejších elektrónových mikroskopov súčasnosti – Titan Krios. O metóde kryoelektrónovej mikroskopie sme sa rozprávali s Dominikom Hrebíkom z Masarykovej univerzity v Brne.

Titan Krios je len jeden z mnohých kryoelektrónových mikroskopov na celom svete, pomocou ktorých je možné vytvárať obrázky biologických systémov s rozlíšením, ktoré bolo donedávna považované za nemožné. Môžete pri blížiť, ako kryoelektrónový mikroskop funguje?
Kryoelektrónový mikroskop funguje na podobnom princípe ako klasické svetelné mikroskopy. Tiež obsahuje sústavu šošoviek a zrkadiel, no na presvetlenie vzorky sa namiesto fotónov používajú elektróny urýchlené napätím až 300 kV a šošovky a zrkadlá nie sú sklené, ale tvoria ich elektromagnetické cievky. Najčastejšie sa na tomto mikroskope študujú biologické vzorky ako vírusy a proteíny. Tie sú v normálnom stave rozpustené v kvapaline, kde sú stabilné aj niekoľko týždňov. Problémom je, že v kvapaline sa voľne pohybujú, a na to, aby sme boli schopní pozorovať vzorky elektrónovým mikroskopom, musia byť vzorky znehybnené vo veľmi tenkej vrstve s hrúbkou iba niekoľko desiatok nanometrov.
 Mgr. Dominik Hrebík pôsobí v laboratóriu štruktúrnej virológie Pavla Plevku na Stredoeurópskom technologickom inštitúte Masarykovej univerzity (CEITEC MU) v Brne. Venuje sa štúdiu bakteriofágov a ľudských enterovírusov, ktoré skúma pomocou kryoelektrónovej mikroskopie. Tiež sa zaujíma o vývoj nových metód pre kryoelektrónovú mikroskopiu. Vyštudoval biochémiu na Masarykovej univerzite v Brne, kde sa pôvodne zaoberal nukleomagnetickou rezonanciou. Usiluje sa popularizovať vedu písaním článkov a zábavnými divadelnými vystúpeniami v súťaži Science Slam.
Mgr. Dominik Hrebík pôsobí v laboratóriu štruktúrnej virológie Pavla Plevku na Stredoeurópskom technologickom inštitúte Masarykovej univerzity (CEITEC MU) v Brne. Venuje sa štúdiu bakteriofágov a ľudských enterovírusov, ktoré skúma pomocou kryoelektrónovej mikroskopie. Tiež sa zaujíma o vývoj nových metód pre kryoelektrónovú mikroskopiu. Vyštudoval biochémiu na Masarykovej univerzite v Brne, kde sa pôvodne zaoberal nukleomagnetickou rezonanciou. Usiluje sa popularizovať vedu písaním článkov a zábavnými divadelnými vystúpeniami v súťaži Science Slam.
Ako sa takéto znehybnenie dosahuje?
 Historicky sa dosahovalo chemicky – vzorka vírusu alebo proteínu sa naviazala na tenký nosič, najčastejšie uhlík, a potom sa vysušená pozorovala pod mikroskopom. Chemikálie a vysušovanie však poškodzujú biologické vzorky do takej miery, že všetky detaily ich štruktúry sa nenávratne stratia. Preto sa v súčasnosti používa tzv. kryometóda imobilizácie, pri ktorej je malé množstvo biologickej vzorky (mikrolitre) nanesené na uhlíkovú mriežku s priemerom 3 mm. Následne sa väčšina vzorky odsaje filtračným papierom tak, aby vznikol veľmi tenký film vzorky s hrúbkou pár desiatok nanometrov, ktorý sa následne ponorí do podchladeného etánu s teplotou -175 °C, pričom sa šokovo zmrazí. Zmrazenie sa udeje tak rýchlo, že ani molekuly vody nestihnú skryštalizovať na ľad – tento proces sa nazýva vitrifikácia a môžeme si ho predstaviť, ako keby sa vo vzorke zastavil čas. Za tento proces bola v roku 2017 udelená spoločná Nobelova cena Jacquovi Dubochetovi.
Historicky sa dosahovalo chemicky – vzorka vírusu alebo proteínu sa naviazala na tenký nosič, najčastejšie uhlík, a potom sa vysušená pozorovala pod mikroskopom. Chemikálie a vysušovanie však poškodzujú biologické vzorky do takej miery, že všetky detaily ich štruktúry sa nenávratne stratia. Preto sa v súčasnosti používa tzv. kryometóda imobilizácie, pri ktorej je malé množstvo biologickej vzorky (mikrolitre) nanesené na uhlíkovú mriežku s priemerom 3 mm. Následne sa väčšina vzorky odsaje filtračným papierom tak, aby vznikol veľmi tenký film vzorky s hrúbkou pár desiatok nanometrov, ktorý sa následne ponorí do podchladeného etánu s teplotou -175 °C, pričom sa šokovo zmrazí. Zmrazenie sa udeje tak rýchlo, že ani molekuly vody nestihnú skryštalizovať na ľad – tento proces sa nazýva vitrifikácia a môžeme si ho predstaviť, ako keby sa vo vzorke zastavil čas. Za tento proces bola v roku 2017 udelená spoločná Nobelova cena Jacquovi Dubochetovi.
Prečo je dôležité skúmať vzorky do najväčších detailov?
Keď sa spýtate štrukturálneho biológa, prečo je jeho práca dôležitá, väčšinou dostanete rovnakú odpoveď, akési nepísané motto štruktúra ukrýva funkciu. V nanosvete je poznanie detailov rovnako dôležité pre pochopenie princípu funkcie stroja ako v makrosvete. Ako paralelu uvediem auto. Keď ho pozorujeme zvonku, vidíme, že sa pohybuje vďaka motoru, ale to, ako funguje motor, zistíme, až keď ho rozoberieme do poslednej skrutky, prípadne získame jeho detailné plány.
Podobne vidia štrukturálni biológovia napríklad ribozómy – obrovské komplexy proteínov a RNA. Vidia, že majú nejakú funkciu – čítajú informáciu z mRNA a na jej základe syntetizujú proteíny, ale presný mechanizmus čítania mRNA a následnej syntézy proteínov sa dá zistiť len tak, že sa získa veľmi detailná štruktúra ribozómu. Veľmi detailná znamená, že sa zistí pozícia všetkých atómov, ktoré ribozóm tvoria.
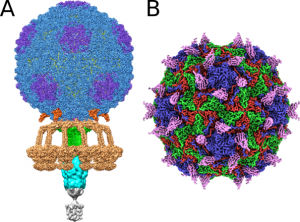
Existujú aj iné metódy na získanie obrazu atomárnej štruktúry?
Desiatky rokov mala takmer monopol na získavanie takto detailných štruktúr röntgenová kryštalografia, v ktorej vedci však musia prinútiť proteíny, aby vytvorili kryštály. Potom tieto kryštály osvietia silným röntgenovým žiarením, ktoré tzv. difraktuje (niečo ako odraz) na väzbách medzi atómami a vytvára obrazce pozícií jednotlivých atómov. Z týchto obrazcov sa dá následne spätne vypočítať, kde v priestore nastala daná difrakcia, čím zistíme pozíciu atómu. Z viac ako 180 000 štruktúr v tzv. proteínovej databanke štruktúr takmer 90 % vrátane dvojzávitnice DNA v roku 1953 bolo získaných röntgenovou kryštalografiou. Táto metóda má však aj nevýhody, napríklad mnoho veľmi dôležitých proteínov nie je možné vykryštalizovať.
Kedy vedci prišli na to, že by bolo možné použiť elektrónovú mikroskopiu aj na vyriešenie štruktúr biomolekúl s rozlíšením podobným tomu, aké ponúka röntgenová kryštalografia?
Keď v roku 1973 Richard Henderson, jeden z laureátov Nobelovej ceny za vývoj kryoelektrónovej mikroskopie (2017), prišiel na Cambridgeskú univerzitu študovať proteín bakteriorhodopsín, podarilo sa mu získať kryštály, ale neboli vhodné pre röntgenovú kryštalografiu. Boli totiž príliš tenké. Preto aj s kolegom Nigelom Unwinom skúsili tieto kryštály presvetliť pod elektrónovým mikroskopom. Zistili, že štruktúru tohto proteínu dokážu vidieť v podobnom detaile ako pomocou röntgenovej kryštalografie. Na to, aby čo i len dosiahli efektivitu kryštalografie, muselo prejsť 40 rokov a vzniknúť mnoho dôležitých metodologických objavov.
Za rozhovor ďakuje redakcia Quarku
Foto D. Hrebík






