Bakteriálny kmeň streptokokov, označovaný GBS, dokáže spôsobiť závažné ochorenia u detí, seniorov, ľudí s oslabenou imunitou a tehotných žien. S nárastom výskytu baktérií odolných proti antibiotikám sa hľadajú nové druhy liečby. S jedným z nich prichádza tím vedcov zo SAV a Univerzity Komenského. O jeho význame a potenciálnom využití sme sa rozprávali s Gabrielou Bukovskou z Ústavu molekulárnej biológie SAV.
Čím sú streptokoky nebezpečné pre novorodencov?
Mnohé streptokoky sa u človeka vyskytujú bežne, iné spôsobujú chorobu len za určitých okolností. Najčastejšie sa však vyskytujú také, ktoré spôsobujú závažné ochorenia. Jedným z nich je aj Streptococcus agalactiae, ktorý spôsobuje infekcie u žien a veľmi vážne infekcie u novorodencov. Tento streptokok zo skupiny B (Group B Streptococcus – GBS) je v súčasnosti hlavnou príčinou novorodeneckej chorobnosti a úmrtnosti, pričom infekcia sa prenáša najčastejšie z matky na plod. Zriedkavo môže dôjsť k infekcii plodových obalov, predčasnému pôrodu, sepse matky aj dieťaťa, ale ochorenie sa môže prejaviť aj ako zápal alebo poškodenie pľúc, poškodenie mozgu či meningitída, ktorá spôsobí poruchu sluchu.
Ako časté sú takéto infekcie u novorodencov?
Streptococcus agalactiae je najčastejšou príčinou vážnych bakteriálnych infekcií u novorodencov. Napríklad za rok 2015 bol počet prípadov celosvetovo stanovený na 0,49 na tisíc novorodencov. Najvyšší bol v južnej Afrike (0,74 až 3,26 na tisíc novorodencov) a najnižší v severnej Ázii (0,09 až 0,32 na tisíc novorodencov). Počet invazívnych infekcií u dojčiat sa za tento rok odhaduje na 320 000 prípadov, ktoré už viedli celosvetovo k približne 90 000 úmrtiam. Novorodenecké infekcie spôsobené týmto patogénom mávajú dve formy, a to infekcie so skorým nástupom do týždňa od narodenia a s neskorým nástupom do troch mesiacov. Novorodenci s infekciou so skorým nástupom boli infikovaní počas pôrodu od matky cez pôrodné cesty a infikovanú plodovú vodu.
Ako sa infekcia prejavuje?
Inhalácia plodovej vody kontaminovanej baktériou GBS vedie ku kolonizácii dýchacích ciest plodu a k vzniku pneumónie. Z pľúc sa GBS baktérie dostávajú do krvného obehu, odkiaľ sú schopné šíriť sa do viacerých orgánov. Prienik baktérií do krvného obehu takisto vedie ku vzniku sepsy (otravy krvi). Menej častými sú infekcie kĺbov, kostí a mäkkých tkanív. Rovnako je menej častá meningitída (zápal mozgových blán), ale GBS baktérie sú schopné prekonať hematoencefalitickú membránu a vyvolať aj toto život ohrozujúce ochorenie. Symptómy ochorenia so skorým nástupom prichádzajú už 24 hodín po pôrode, ochorenia s neskorším nástupom sú zriedkavejšie.
 Ako prebieha liečba infekcií? Prečo sa hľadajú nové spôsoby liečby?
Ako prebieha liečba infekcií? Prečo sa hľadajú nové spôsoby liečby?
Klasická liečba spočíva v podávaní antibiotík, pričom pri liečbe tehotných žien sa dôraz kladie na prevenciu. Tehotným ženám sa robí skríning v 35. až 37. týždni tehotenstva a ženy pozitívne na prítomnosť GBS sa liečia podávaním antibiotík ešte pred pôrodom, prípadne aj počas pôrodu. Najčastejšie sa aplikuje penicilín, v prípade prítomnosti GBS rezistentných na penicilín alebo pri alergii sa pacientom podávajú ďalšie z radov antibiotík: cefazolín, klindamycín, erytromycín alebo vankomycín. Odhadovaný výskyt alergických reakcií pri liečbe penicilínom je 0,7 až 4 % zo všetkých liečených prípadov, pričom riziko anafylaxie je odhadom 4/100 000 až 4/10 000 recipientov. Navyše nedávne klinické štúdie ukázali, že podávanie antibiotík tehotným ženám môže byť spojené aj s negatívnymi účinkami na novorodenca, ako je napríklad vznik nekrotizujúceho zápalu čreva. Práve pre nevýhody liečby antibiotikami a rekurencie (opakovaný výskyt infekcie) sa hľadajú nové možnosti terapie.
 RNDr. Gabriela Bukovská, CSc., je vedúcou pracovnej skupiny genomiky v rámci oddelenia genomiky a biotechnológií na Ústave molekulárnej biológie SAV v Bratislave. V rokoch 1991 až 1993 absolvovala stáž v laboratóriu prof. J. P. Krausa na University of Colorado Health Sciences Centrum v americkom Denveri, kde sa podieľala na analýze génu ľudskej cystationínovej betasyntázy (CBS). Po návrate v roku 1994 sa začala venovať štúdiu bakteriofágov priemyselne významných mikroorganizmov a charakterizácii ich replikačných a lytických proteínov. V súčasnosti sa jej skupina venuje replikácii fágovej DNA, izolácii a charakterizácii lytických enzýmov a bioinformatickej analýze fágových genómov.
RNDr. Gabriela Bukovská, CSc., je vedúcou pracovnej skupiny genomiky v rámci oddelenia genomiky a biotechnológií na Ústave molekulárnej biológie SAV v Bratislave. V rokoch 1991 až 1993 absolvovala stáž v laboratóriu prof. J. P. Krausa na University of Colorado Health Sciences Centrum v americkom Denveri, kde sa podieľala na analýze génu ľudskej cystationínovej betasyntázy (CBS). Po návrate v roku 1994 sa začala venovať štúdiu bakteriofágov priemyselne významných mikroorganizmov a charakterizácii ich replikačných a lytických proteínov. V súčasnosti sa jej skupina venuje replikácii fágovej DNA, izolácii a charakterizácii lytických enzýmov a bioinformatickej analýze fágových genómov.
Nestačili by nové antibiotiká?
Veľkým problémom je rastúci počet bakteriálnych kmeňov, ktoré sú rezistentné proti viacerým antibiotikám a nazývajú sa multirezistentné. Už v roku 2004 sa pri testovaní citlivosti GBS izolovaných od tehotných žien proti antibiotikám dokázala znížená citlivosť na ampicilín (17 %), penicilín (15 %) a rezistencia na klindamycín (19 %) a cefazolín (15 %). Aj preto sa hľadajú alternatívne spôsoby liečby. Vývoj nových antibiotík je pre veľké farmaceutické spoločnosti ekonomicky menej zaujímavý a za posledných 15 až 20 rokov nebola zavedená do medicínskej praxe ani jedna nová skupina antibiotík. Jedno z potenciálnych riešení je napríklad využitie fágov (vírusy infikujúce a množiace sa v baktériách) a ich proteínových produktov v humánnej a veterinárnej terapii. Pracuje sa tiež na vývoji vakcíny, ktorá by chránila všetky vekové kategórie pred nákazou GBS. Vo svete a v Európskej únii sa výskumu v oblasti endolyzínov (proteíny schopné ničiť baktérie) venuje oveľa väčšia pozornosť, na Slovensku ide o prvý takýto produkt.
Môžete nám priblížiť riešenie, s ktorým prichádzate vy?
 Fágová terapia využíva bakteriofágy (skrátene fágy) a ich produkty pri liečbe infekčných ochorení spôsobených baktériami. Pôvodne sme si zvolili za cieľ prípravu terapeutických bakteriofágov vhodných na liečbu infekcií spôsobených Streptococcus agalactiae, účinných aj v prípade multirezistentných bakteriálnych pôvodcov. Bakteriofágy a fágové proteíny majú veľa výhod, pretože sú veľmi špecifické, infikujú len svojich bakteriálnych hostiteľov, nie sú toxické pre zvieratá alebo rastliny a zároveň sú schopné reprodukcie počas infekčného cyklu.
Fágová terapia využíva bakteriofágy (skrátene fágy) a ich produkty pri liečbe infekčných ochorení spôsobených baktériami. Pôvodne sme si zvolili za cieľ prípravu terapeutických bakteriofágov vhodných na liečbu infekcií spôsobených Streptococcus agalactiae, účinných aj v prípade multirezistentných bakteriálnych pôvodcov. Bakteriofágy a fágové proteíny majú veľa výhod, pretože sú veľmi špecifické, infikujú len svojich bakteriálnych hostiteľov, nie sú toxické pre zvieratá alebo rastliny a zároveň sú schopné reprodukcie počas infekčného cyklu.
V súčasnosti sa viacero komerčných spoločností aktívne podieľa na vývoji nových fágových produktov. Na vhodnú liečbu pomocou fágovej terapie je potrebné okrem identifikácie cieľovej patogénnej baktérie mať k dispozícii aj proti nej špecifický lytický bakteriofág, prípadne ich zmes. Celosvetovo sa však aj napriek mnohým štúdiám lytické bakteriofágy špecifické proti druhom GBS vyskytujúcim sa u ľudí nepodarilo izolovať. Boli identifikované iba temperované bakteriofágy. Tie môžu zostať zabudované v genóme hostiteľskej bunky v pokoji aj niekoľko generácií a až za vhodných podmienok sa aktivujú a prechádzajú do lytického stavu.
Tie nie sú vhodné?
Temperované fágy práve pre ich schopnosť integrácie do chromozómu nie sú vhodné na použitie vo fágovej terapii. Súčasťou genómov temperovaných bakteriofágov sú však lytické proteíny holín a endolyzín. Endolyzíny sú enzýmy bakteriofágov, ktoré slúžia na degradáciu peptidoglykánu hostiteľských buniek na konci lytického cyklu bakteriofágov a následne dochádza k lýze, teda rozkladu bakteriálnych buniek a uvoľneniu fágových viriónov (základných častíc vírusu) do prostredia. Substrátom endolyzínov je peptidoglykán bunkovej steny baktérií. Pri grampozitívnych baktériách je dostupný z vonkajšieho prostredia, a preto je možné aplikovať endolyzíny proti grampozitívnym baktériám externe. Kmene Streptococcus agalactiae často obsahujú vo svojom genóme aj DNA profágov (bakteriofág, ktorý je integrovaný v baktérii), ktorých súčasťou sú aj mnohé endolyzíny. Ako jednu z možností liečby infekcií spôsobených Streptococcus agalactiae sme si zvolili využitie fágových endolyzínov.
Čím sa líši vami pripravený endolyzín od iných?
V súčasnosti je identifikovaných niekoľko endolyzínov s terapeutickým potenciálom pri liečbe infekcií spôsobených streptokokmi skupiny B, ktoré sú však chránené patentmi. V našom laboratóriu v spolupráci so spolupôvodkyňou z Univerzity Komenského sa nám podarilo pripraviť endolyzín EN534-C. Je prvým endolyzínom pôvodom z profágu humánneho izolátu Streptococcus agalactiae KMB-534, patriaceho do skupiny betahemolytických streptokokov (GBS), sérotyp III. Proteín endolyzínu EN534-C má unikátne usporiadanie lytických a väzbových aktívnych domén, ktoré sa podieľajú na degradácii peptidoglykánu. Obsahuje dve katalytické domény, označované ako amidáza_3 a CHAP, a jednu väzbovú doménu LysM, ktorá určuje špecificitu endolyzínu.
Ako účinkuje?
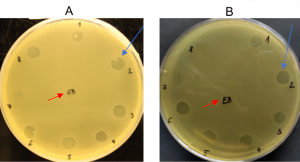 Experimentálne sme potvrdili špecifické pôsobenie endolyzínu EN534-C proti viacerým kmeňom streptokokov, najmä proti patogénnej baktérii Streptococcus agalactiae (GBS). Lytické pôsobenie EN534-C na bakteriálnu kultúru vidno v podobe vytvárania čírych zón v mieste kvapnutia endolyzínu na médium s bakteriálnym substrátom v Petriho miskách. Endolyzín nielen degraduje bakteriálnu bunku, ale zabraňuje ďalšiemu rastu baktérií v mieste jeho aplikácie. Po pridaní endolyzínu dochádza do dvadsiatich minút k degradácii peptidoglykánu a k postupnému vyčíreniu bakteriálneho substrátu. Pomocou fluorescenčného mikroskopu sa nám podarilo dokázať v reálnom čase, že po pridaní endolyzínu k bunkám Streptococcus agalactiae dochádza k praskaniu buniek a vyliatiu celého bunkového obsahu do prostredia.
Experimentálne sme potvrdili špecifické pôsobenie endolyzínu EN534-C proti viacerým kmeňom streptokokov, najmä proti patogénnej baktérii Streptococcus agalactiae (GBS). Lytické pôsobenie EN534-C na bakteriálnu kultúru vidno v podobe vytvárania čírych zón v mieste kvapnutia endolyzínu na médium s bakteriálnym substrátom v Petriho miskách. Endolyzín nielen degraduje bakteriálnu bunku, ale zabraňuje ďalšiemu rastu baktérií v mieste jeho aplikácie. Po pridaní endolyzínu dochádza do dvadsiatich minút k degradácii peptidoglykánu a k postupnému vyčíreniu bakteriálneho substrátu. Pomocou fluorescenčného mikroskopu sa nám podarilo dokázať v reálnom čase, že po pridaní endolyzínu k bunkám Streptococcus agalactiae dochádza k praskaniu buniek a vyliatiu celého bunkového obsahu do prostredia.
Aké sú výhody proteínu EN534-C v porovnaní s existujúcou liečbou?
Hlavným prínosom je získanie nového preparátu vhodného predovšetkým na prevenciu a liečbu vaginálnych infekcií u žien a jeho aplikácia pri bakteriálnych infekciách dolných močových ciest. Získali sme preparát potenciálne využiteľný nielen pri liečbe streptokokových infekcií, ale aj pri ich profylaxii. Endolyzín sa dá aplikovať aj na kožu a možno uvažovať o jeho aplikácii aj vo forme aerosólu do hrdla.
Aplikáciou endolyzínu sa rozširujú možnosti liečby hlavne opakovaných infekcií. Jeho aplikácia je vhodná aj v prípade pacientov, kde sa použitie antibiotík neodporúča, najmä u tehotných žien a novorodencov. Používanie preparátu endolyzín EN534-C umožní liečiť aj infekcie spôsobené multirezistentnými bakteriálnymi kmeňmi GBS a zabráni sa tak šíreniu rezistentných kmeňov v populácii. V určitých prípadoch pre zvýšenie účinku pôsobenia možno endolyzín aplikovať synergicky spolu s antibiotikami. Endolyzín EN534-C je špecifický, pôsobí hlavne na kmene streptokokov a nepôsobí na dobré baktérie, ako sú napríklad kmene laktobacilov. Doteraz sa tiež nepotvrdil vznik rezistencie baktérií proti endolyzínu. Samotný proteín má výhodu tepelnej manipulácie, je tepelne stabilný v rozmedzí teplôt od 20 do 42 °C a možno ho izolovať pri laboratórnej teplote. Tým sa zároveň znižuje energetická náročnosť izolácie rekombinantného proteínu pri potenciálnej biotechnologickej príprave.

Na čo všetko je možné využiť endolyzín EN534-C?
Nový endolyzín EN534-C predstavuje cielený prípravok predovšetkým na liečbu streptokokových vaginálnych infekcií a infekcií močových ciest. V literatúre je popísaná napríklad úspešná liečba endolyzínom pri infekcii ústnej sliznice vyvolanej Streptococcus pyogenes a infekcii nosa spôsobenej pneumokokmi. Preparát endolyzínu EN534-C má veľký potenciál aj v prípadoch liečby nehojacich sa rán a žilových vredov infikovaných streptokokmi.
EN534-C má tiež prípadné využitie vo veterinárnej medicíne napríklad na liečbu mastitíd alebo povrchových infekcií zvierat. Izolovaný preparát endolyzínu možno použiť aj pri dekontaminácii povrchov v súvislosti s výskytom streptokokov v nemocniciach.
Má liečba pomocou EN534-C vedľajšie účinky?

Na rozdiel od antibiotík predstavujúcich malé neimunogénne molekuly sú endolyzíny proteíny, ktoré stimulujú imunitnú reakciu hostiteľa pri systémovom aj mukóznom podaní. Pri potenciálnom použití EN534-C na liečbu infekcií je zatiaľ predčasné hovoriť o vedľajších účinkoch, keďže sme tento proteín ako liečivo ešte netestovali. To sa robí až pri prvých predklinických štúdiách. Môžeme len konštatovať, že výsledky z doterajších štúdií týkajúce sa bezpečnosti a imunogenicity mnohých endolyzínov ukazujú, že endolyzíny použité ako terapeutiká a antimikrobiálne látky nepredstavujú riziko pre ľudí a majú iba minimálny alebo nemajú nijaký účinok na prospešné baktérie.
Možno považovať váš výskum už za ukončený?
Bakteriofágom a fágovým proteínom sa naša malá riešiteľská skupina venuje viac ako dve desaťročia. Zaoberáme sa najmä základným výskumom, pričom sa stretávame aj s otázkou využitia našich poznatkov a prenosom výsledkov do praxe. V minulom období sme okrem iných proteínov úspešne izolovali dva nové endolyzíny z fágov infikujúcich priemyselné mikroorganizmy, ale bez praktickej aplikácie. V súčasnosti sa venujeme izolácii endolyzínov účinných proti patogénnym streptokokom.
Náš výskum nie je vôbec na konci, v podstate by sa dalo povedať, že sme na začiatku úspešnej cesty. Plánujeme izolovať a charakterizovať ďalšie proteíny s lytickou aktivitou proti streptokokom, rozširovať ich antibakteriálnu špecificitu a zvyšovať ich aktivitu. Vo svete neustále pribúdajú nové produkty aj na báze bakteriofágov a ich proteínov. To bolo tiež jedným z podnetov, prečo sme sa rozhodli podať na nový endolyzín EN534-C patentovú prihlášku. Zároveň to bude vhodným ukončením riešeného projektu APVV, ale nie nášho výskumu. Na pokračovanie vo výskume potrebujeme financie, ktoré v našom prípade získavame písaním ďalších vedeckých projektov a uchádzaním sa o financie z grantových agentúr.
 Usilujete sa aj o uvedenie riešenia do praxe?
Usilujete sa aj o uvedenie riešenia do praxe?
Pôvodne sa to začalo otázkou môjho lekára, či je možné pomôcť ženám hlavne s opakujúcimi sa infekciami urogenitálneho traktu, v ktorom už antibiotiká prestávajú pôsobiť. Úspešne sme sa uchádzali o vedecký projekt a jedným z výsledkov riešenia je aj príprava a izolácia nášho endolyzínu EN534-C. Sme však vedeckí pracovníci a s prenosom výsledkov do praxe nemáme skúsenosti. Určite by to bol veľký úspech a zadosťučinenie, keby sa podarilo nájsť spoločnosť, ktorá by prejavila o náš prípravok záujem. Momentálne s Kanceláriou pre transfer technológií SAV hľadáme partnera na spoluprácu, aby sme mohli posunúť náš výskum ďalej do praxe.
Za rozhovor ďakuje redakcia Quarku
Foto Pixabay
Na príprave rekombinantného endolyzínu EN534-C sa spolu s G. Bukovskou spolupodieľali RNDr. Lucia Bocánová, PhD., RNDr. Nora Halgašová, PhD., a RNDr. Mária Kajsiková, PhD., z Ústavu molekulárnej biológie SAV a doc. RNDr. Hana Drahovská, PhD., z Univerzity Komenského v Bratislave. Nový proteín, spôsob jeho prípravy a použitie sú predmetom prioritnej národnej patentovej prihlášky.