Čo je najobyčajnejšia tekutina na našej planéte, vie asi každý. Je ňou, samozrejme, voda. To, či každý vie, čo je vlastne tekutina, ale zároveň aj voda, nie je vôbec isté.

Čo je tekutina? Na túto otázku vie nejakým spôsobom odpovedať každý. Tu však platí, tak ako v mnohých iných prípadoch, že existuje viacero významov tohto slova. Pre väčšinu z nás znamená nejakú kvapalinu. Napríklad v súvislosti s obľúbenými radami o pitnom režime pod ňou myslíme rôzne zdraviu prospešné alebo aspoň neškodné tečúce látky. Môže to byť obyčajná voda, roztok cukru, alkoholu či iných látok vo vode (prípadne aj s oxidom uhličitým) alebo aj vodná suspenzia. V poslednom prípade ide o nerozpustné látky ako ovocie či iné časti rastlín rozptýlené vo vode. Samozrejme, v prípade alkoholu nie je väčšinou podmienka zdravotnej neškodnosti splnená. Pod tekutinou si teda vo všeobecnosti predstavujeme najmä kvapalinu.

Kvapalina a plyn
Vo fyzike a chémii je slovo tekutina spoločným názvom pre kvapaliny a plyny. To je práve to, čo mnohí nevedia. Pre tento spoločný názov existujú dva dôvody. Obe skupenstvá totiž tečú, sú tekuté, čo znamená, že vo veľkom objeme nie sú schopné udržať si pevný tvar. Druhý dôvod súvisí s tým, že v laboratóriách a aj v prírode existujú také podmienky definované tlakom a teplotou, pri ktorých oba tieto stavy nijako nedokážeme od seba odlíšiť. Samozrejme, že to nejde, pretože tvoria spoločnú homogénnu fázu. Na to, aby sme dokázali tento podivný stav oceniť, pripomeňme si hlavné rozdiely medzi kvapalinami a plynmi.
Pre jednoduchosť a zároveň aj v súvislosti s témou tohto článku sa držme vody a sústreďme sa iba na tie najviditeľnejšie rozdiely. Hustota kvapalnej vody je výrazne vyššia ako hustota pary. Aj vďaka tomu môžeme vodu vidieť a všimnúť si aj jej farebné odtiene pri rôznych zdrojoch a uhloch osvetlenia. Para je (takmer) neviditeľná. To, čo obyčajne označujeme ako paru, napríklad nad kuchynským hrncom, nie je para, ale kondenzované mikroskopické kvapôčky vody. Možnosti uvidieť, resp. neuvidieť vodnú paru sú pre väčšinu z nás veľmi obmedzené, pretože aj keď vypustíme vodnú paru napríklad s teplotou 300 °C z nádoby alebo potrubia s vysokým tlakom do voľného priestoru, vo vzduchu veľmi rýchlo kondenzuje na známe biele obláčiky. Musíme si však dať veľký pozor, aby sme to pozorovali z dostatočnej vzdialenosti, pretože popáliť sa takouto parou je mimoriadne nebezpečné.
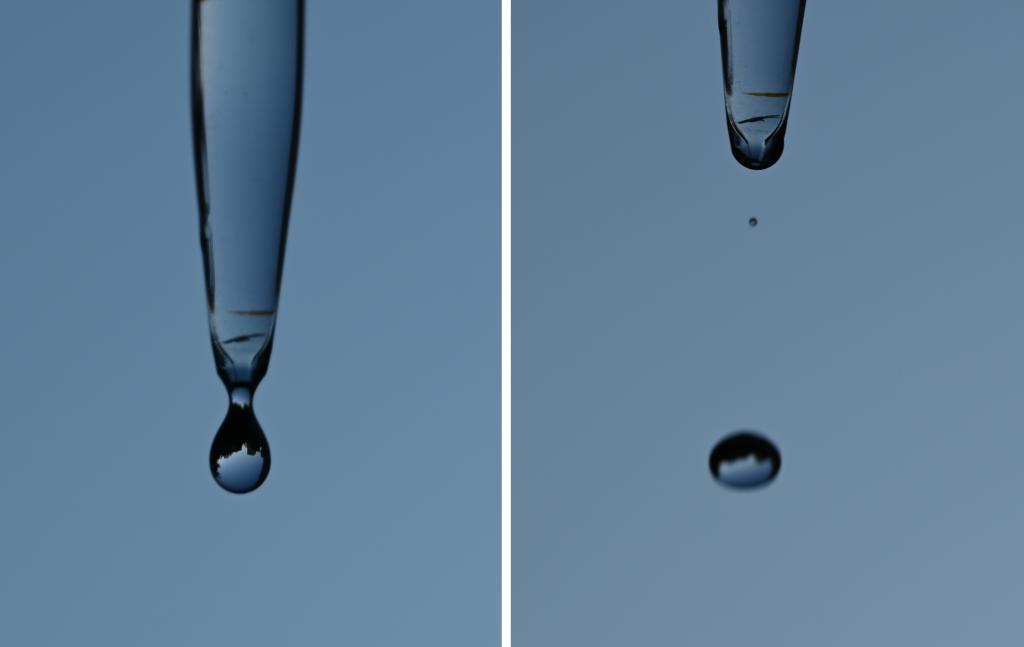
Tvar kvapky
Výrazným rozdielom medzi oboma skupenstvami vody je aj to, že plyny na rozdiel od kvapalín nevytvárajú kvapky. Je zaujímavé, že samotné slovo kvapka má tiež viac významov. Prvý je označením typického tvaru vody pri pomalom vytekaní z rúry alebo kapiláry. Druhý je vyjadrením malého objemu. Napríklad do čaju pridávame pár kvapiek citrónovej šťavy. Táto orientačná jednotka objemu sa často používa aj v laboratórnych experimentoch. Pri titráciách pridávame do roztoku povedzme tri kvapky indikátora. Rôzne chemické postupy nám radia, že pre hrubú úpravu pH roztoku je doň potrebné pridať päť kvapiek niečoho iného.
Celkom zábavné na kvapkách je pritom to, že kvapky vody letiace z kapiláry, rúry alebo aj oblakov nemajú vôbec tvar kvapky, ale gule. Samozrejme, tá je zvyčajne viac alebo menej deformovaná odporom vzduchu. Tvar gule, ako aj tvar kvapky súvisia s povrchovým napätím vody. Sily, ktoré držia malé objemy vody pokope, ich vytvarujú do priestoru s najmenším možným povrchom, a tým je práve guľa. Výtok kvapky z kapiláry je zasa bojom medzi silami držiacimi kvapku v kontakte s vodou v kapiláre a gravitáciou, ktorá nad nimi chce zvíťaziť.
Mimochodom, jedna z metód zisťovania povrchového napätia kvapalín túto hodnotu odvodzuje od hmotnosti jej kvapky. Takže vo všeobecnosti tá nie je veľmi presnou metódou merania objemu. No pri jednej kvapaline, ktorá má túto hodnotu rovnakú, je to celkom v poriadku.

Ani jedno, ani druhé
Rozdiely medzi skupenskými stavmi sú obrovské a každý z nás väčšinu z nich pozná. Ich vzájomná premena je skokovou zmenou, ktorá sa deje pri určitých jednoznačných podmienkach. Na fázovom diagrame vody zmenu premeny kvapaliny na paru vyjadruje plynulá krivka tvorená konkrétnymi dvojicami teplôt a tlaku. Z nej je jasné, pri akej teplote vrie voda na vrchole Kriváňa či Mount Everestu.
Táto krivka sa končí tzv. kritickým bodom, nad ktorým je niečo, čo nie je ani kvapalinou, ani parou, ale v závislosti od tlaku a teploty sa približuje k jednému alebo druhému. Tento stav sa volá superkritická tekutina. Práve to je to, čo tiež zjednocuje oba skupenské stavy do jedného termínu tekutina (ang. fluid). Väčšina z nás ju v prípade vody nikdy nevidela a ani nikdy neuvidí, pretože podmienky jej existencie sú veľmi drastické, teda výrazne sa líšiace od toho, na čo sme v bežnom živote zvyknutí. Sú nad teplotou 374 °C a nadtlakom 22,1 MPa.
Viac o tomto zvláštnom stave vody sme písali v Quarku 1/2018. Superkritické stavy vody sú vo vede, technike a aj priemysle mimoriadne žiadané. Dôvod je veľmi jednoduchý. Nevyberáme si iba z dvoch hraničných stavov, teda kvapalnej vody alebo jej pary, ale z veľkého spektra iných možností. A im zodpovedajú aj rôzne fyzikálne a chemické vlastnosti tejto tekutiny.
Voda naša obyčajná
Otázkou, čo je voda, by sme mnohých asi urazili, no väčšina tých neurazených odpovedí by asi mala formu príkladov: To je to, čo tečie z vodovodu alebo v blízkom potoku, rieke a pod. Skúsme vymyslieť niečo lepšie.
Voda je predovšetkým názov molekuly obsahujúcej dva atómy vodíka a jeden atóm kyslíka (H2O). Ďalej je to názov reálnej látky pozostávajúcej práve z týchto molekúl, a to vo všetkých jej skupenstvách. Zároveň je to aj špeciálne názov jej kvapalného skupenstva. Vodou sa väčšinou nazýva všeličo možné, v čom hlavnú zložku tvorí práve uvedená chemická látka. Patria tam destilovaná voda v našich laboratóriách, čistá voda tatranských plies, voda potokov, riek a jazier, dažďová, pitná a nepitná voda, minerálne vody, morská voda, voda ľadovcov, priemyselné odpadové vody, voda v chladiacich a ohrevných zariadeniach, voda mäkká a tvrdá, ale aj voda v kolene, plodová voda a mnohé iné.
Takmer všetky do jedného sú vlastne zmesou veľkého počtu látok zahrnujúcou rôzne rozpustené plyny a soli, nerozpustné organické a anorganické častice, baktérie, vírusy a iné mikroorganizmy, živé či mŕtve a veľa ďalších. To, v čom sa líšia, je zastúpenie týchto nevodných zložiek, takže vypitie pohára jednej z nich vám môže celkom dobre uhasiť smäd, ale aj vás dostať na druhý svet. A medzi týmito dvoma možnosťami existuje celý rad iných.

Chemicky čistá aj ťažká
Nie je asi prekvapením, že tá chemicky najčistejšia voda nepatrí k tým najzdravším. Samotný výraz chemicky čistá voda je veľmi relatívny pojem, pretože aj keď obsah jej nečistôt je zvyčajne nízky, vždy sa môže pohybovať v rozsahu mnohých rádov. Takže, keď nalejete tú chemicky najčistejšiu vodu do čistej sklenej kadičky, tak ste ju práve zbavili jej panenskej čistoty, pretože aj veľmi nízka rozpustnosť skla vo vode ju o túto čistotu pripraví.
A potom je tu aj ťažká voda deutérium (D2O) obsahujúca izotop vodíka. Jej hustota je približne o 10 % vyššia ako tej normálnej. Z toho pramení aj jej prívlastok ťažká.
Názov tohto článku hovorí o najobyčajnejšej tekutine. Paradoxom je, že tá vôbec obyčajnou nie je. Uznáme to až vtedy, keď vodu porovnáme s inými podobnými látkami.
Text a foto prof. Ing. Karol Jesenák, CSc.






