Bakteriofágy (fágy) sú vírusy, ktoré infikujú baktérie. Patria k najviac rozšíreným organizmom na Zemi a regulovaním množstva baktérií zabezpečujú ekologickú rovnováhu v prírode. Mohli by sa stať zbraňou v boji s bakteriálnymi infekciami.
Fágy sú všadeprítomné a možno ich nájsť vo všetkých rezervoároch bakteriálnych hostiteľov, akými sú pôda a vnútornosti živočíchov. Jedným z najbohatších prírodných zdrojov fágov je morská voda. Predpokladá sa, že až 70 % morských baktérií je infikovaných. Bakteriofágy boli identifikované koncom 19. storočia, od dávnych čias však existovali doložené správy o riečnych vodách, ktorými sa liečili infekčné choroby, napríklad malomocenstvo.
Od objavu po Nobelovu cenu
V roku 1896 Ernest Hankin Hanbury informoval, že niečo vo vodách riek Ganga a Jumna v Indii má antibakteriálne účinky a prechádza cez veľmi jemný porcelánový filter. V roku 1915 britský bakteriológ Frederick Twort, riaditeľ Brown Institute of London, skúmal pôvodcu bakteriálnych infekcií. Vyslovil myšlienku, že za smrť baktérií zodpovedá buď istý stupeň ich životného cyklu, enzým, ktorý produkujú, alebo nejaký vírus. Twortovu prácu prerušila prvá svetová vojna a nedostatok finančných prostriedkov. Nezávisle od Tworta francúzsko-kanadský mikrobiológ d’Herelle, zamestnanec Pasteurovho inštitútu v Paríži, 3. septembra 1917 oznámil, že objavil neviditeľný mikrób, ktorý zabíja bacil dyzentérie. D’Herelle ho nazval požieračom baktérií, teda bakteriofágom (názov zložený zo slov baktéria a z gréckeho phagein – jesť, požierať). Zaznamenal aj prípad človeka trpiaceho hnačkami, ktorý sa vyliečil pomocou fágov. Za výskum bakteriofágov bola v roku 1930 udelená Nobelova cena molekulárnemu biológovi Maxovi Delbrückovi.
Fágová terapia verzus antibiotiká
Terapia bakteriálnych infekcií ľudí a zvierat fágmi sa teda začala využívať už pred vyše storočím. Dobré výsledky v tom čase zaznamenali lekári v Indii pri liečbe cholery či čierneho moru. V západných krajinách utlmil vedecký záujem o fágovú terapiu na desiatky rokov objav antibiotík. To však nebol prípad východnej Európy, najmä krajín bývalého Sovietskeho zväzu. Inštitút Eliava v gruzínskom Tbilisi, založený už v roku 1920, je ešte vždy jedným z najvýznamnejších centier fágovej terapie na svete. Aj v západných krajinách postupne vzrastá záujem o využitie fágov ako potenciálnych liečiv v boji proti rastúcemu počtu bakteriálnych infekcií odolných proti antibiotikám.
Proti odolným baktériám
Výskumníci z Baylor College of Medicine a z Michael E. DeBakey Veterans Affairs Medical Center v Houstone (USA) zisťovali, či fágy môžu byť efektívne v boji proti veľkej skupine odolných baktérií, ktoré spôsobujú u ľudí smrteľné ochorenia.
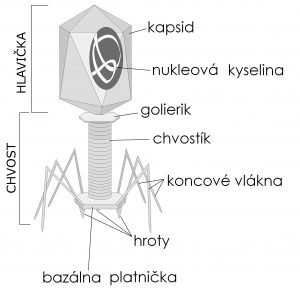
Korešpondujúci autor štúdie, ktorá bola publikovaná v časopise Scientific Reports, Dr. Anthony Maresso, docent molekulárnej virológie a mikrobiológie v Baylor College of Medicine, vysvetľuje: Keď sa baktérie nekontrolovateľne množia, vstupujú do krvi a infikujú vitálne orgány tela. Imunitný systém reprezentovaný množstvom buniek a molekúl odpovedá na bakteriálny atak, aby ochránil organizmus pred infekciou. Niekedy je však imunitná odpoveď neúmerná a môže viesť k zlyhaniu orgánov – k procesu, ktorý sa nazýva sepsa. Liečba antibiotikami zastaví množenie baktérií a môže zabrániť smrteľným dôsledkom sepsy. Veľkým problémom v poslednej dobe je však už spomínaný zvyšujúci sa počet baktérií odolných proti antibiotikám. Podľa National Institute of General Medical Sciences sa sepsa každoročne vyskytuje u viac ako milióna ľudí v USA. Okolo päťdesiat percent týchto ľudí zomiera, čo prevyšuje počet úmrtí v dôsledku nádorov prostaty a prsníkov spolu s AIDS. Množstvo prípadov sepsy sa z roka na rok zvyšuje, čo poukazuje na nevyhnutnosť vývoja nových stratégií v boji proti bakteriálnym infekciám. Hlavným zámerom nášho projektu bolo nájsť fágy, ktoré by zabili 12 kmeňov baktérií odolných proti antibiotikám izolovaných z pacientov, hovorí spoluautor výskumu, profesor molekulárnej virológie a mikrobiológie v Baylor College of Medicine, Dr. Robert Ramig. Mojou prvou úlohou ako virológa v tíme bolo získať fágy, dodáva.
Záujem o vtáčie hniezda a výkaly
Dr. Ramig vysvetľuje: V laboratóriu som mal množstvo fágov, ale žiadny z nich nebol schopný zlikvidovať rezistentný kmeň baktérie Escherichia coli, sekvenčný typ 131, s ktorým sme pracovali, a ktorý je príčinou súčasných svetových pandémií. Prírodnými rezervoármi baktérií, o ktoré sa výskumníci zaujímali, sú psy a vtáky. Zároveň sú v ich telách prítomné aj fágy špecifické pre tieto baktérie. Ramig, Maresso a Sabrina Greenová – študentka molekulárnej virológie v Baylor College of Medicine, sa vybrali do parkov, aby tam vyhľadali vtáčie hniezda a získali psie a vtáčie exkrementy. Zo živočíšnych výkalov sme izolovali množstvo fágov, hovorí Dr. Ramig a pokračuje: Ani jeden fág nezlikviduje všetkých 12 bakteriálnych kmeňov sám, ale dva či tri fágové kmene v súčinnosti by boli schopné zabiť všetky tieto baktérie v laboratórnych kultúrach. Výskumníkov však zaujímalo, či by tieto fágy boli schopné zlikvidovať rezistentné baktérie nielen v laboratórnych podmienkach, ale aj v živočíšnom modeli sepsy.

Študijný model sepsy

Jeden zo živočíšnych modelov, s ktorým výskumníci pracovali, simuluje možnosť vzniku smrteľných bakteriálnych infekcií u pacientov s nádormi podstupujúcich onkologickú liečbu. U mnohých pacientov liečených chemoterapiou sa niekedy vyvinie infekcia, ktorej príčinou sú baktérie žijúce v ich črevách. Tieto baktérie im za normálnych podmienok nespôsobujú problémy. Na rozdiel od antibiotík by fágy nemali mať negatívne vedľajšie účinky na pacienta, akým je napríklad eliminácia zdraviu prospešných črevných mikroorganizmov. Chemoterapia zabíja nádorové bunky, ale jedným z jej vedľajších účinkov je to, že potláča imunitný systém. Oslabený imunitný systém je hlavným rizikovým faktorom pri infekciách týmito baktériami, lebo sú neraz multirezistentné, teda odolné proti početným antibiotikám. Sabrina Greenová vyvinula v laboratóriu Dr. Maressa model, v ktorom bola zdravá myš infikovaná istým rezistentným bakteriálnym kmeňom kolonizujúcim jej tráviaci trakt. Takáto myš nevykazovala známky infekcie. Keď myš podstúpila chemoterapiu, baktérie z čreva sa rozšírili do dôležitých orgánov, čo viedlo k závažnej infekcii podobnej sepse. Na tomto modeli, v ktorom imunitný systém nie je schopný poradiť si s infekciou odolnými baktériami, študovala Sabrina Greenová účinky fágov. Dr. Maresso hovorí: Keď sa fágy dopravili do tela zvieraťa, ich efektivita redukovať baktérie a prispieť tak k liečbe, bola enormná. Fascinujúce je však to, že liečivá na báze fágov sme izolovali, identifikovali a testovali v priebehu niekoľkých týždňov a za menej peňazí, než ktoré pravdepodobne väčšina z nás minie mesačne na potraviny.
Špecifické a adaptabilné liečivo
Fágy sú špecifické pre určité druhy alebo kmene baktérií, ale vo forme koktailov môžu pôsobiť širokospektrálne. Na rozdiel od antibiotík by fágy nemali mať negatívne vedľajšie účinky, akým je napríklad eliminácia zdraviu prospešných črevných mikroorganizmov. Navyše fágy nenapádajú ľudské bunky. Ďalšou výhodou v porovnaní s antibiotikami je to, že fágy sú schopné meniť sa. Ak sa vyvinie rezistencia baktérií proti určitej skupine fágov, z prostredia možno izolovať nové, alebo ich možno za niekoľko dní získať v laboratórnych podmienkach. Na rozdiel od fágov je antibiotikum chemikália, ktorá je štruktúrne stabilná, hovorí Dr. Maresso. Vývoj nového antibiotika trvá roky a cena sa môže vyšplhať k biliónom. Fág je však schopný meniť svoju štruktúru, jeho základným cieľom je efektívne eliminovať odolný bakteriálny kmeň a rozmnožovať sa. Spoluautorka výskumu Dr. Barbara Trautnerová, docentka a vedúca klinického výskumu na Department of Surgery, docentka medicíny v Baylor College of Medicine a tiež výskumníčka v Center for Innovation in Quality, Effectiveness and Safety v Michael E. DeBakey Veterans Affairs Medical Center, spolu s Dr. Ramigom už dávnejšie publikovali článok, v ktorom ukázali, že v boji proti bakteriálnym infekciám je možné využiť schopnosť fágov meniť sa. Dr. Ramig ozrejmuje: Celkovo sme využili štyri typy fágov, ktoré špecificky atakujú baktérie rodu Pseudomonas a ktoré by boli potenciálne schopné eliminovať iba 4 z 26 druhov tohto rodu. Neskôr sme v laboratóriu vyvinuli fágy, ktoré boli schopné za mesiac zabiť 22 z 26 druhov rodu Pseudomonas.
Experimenty na overenie liečby
Vedci načrtli budúci možný klinický scenár pre pacienta s bakteriálnou infekciou odolnou proti antibiotikám: za 48 hodín možno uňho identifikovať bakteriálny druh a kmeň.

Lekári a výskumníci budú mať k dispozícii akúsi fágovú knižnicu, vyberú fágy efektívne proti príslušnému bakteriálnemu kmeňu a vytvoria z nich koktail na účinnú liečbu príslušného pacienta. Ak sa objaví u pacienta rezistencia, možno vyvinúť fágy so zmenenou štruktúrou. Dr. Maresso tvrdí: Existuje veľa ciest eliminácie baktérií, ale nepoznám nijaký iný spôsob, ktorý má potenciál vyvíjať sa v reálnom čase tak, ako to dokážu fágy. A to je tá najlepšia zelená medicína. Je prírodná, bezpečná, relatívne lacná a technicky jednoduchá. Fágy nie sú toxické pre ľudí ani pre zvieratá a majú len málo vedľajších účinkov. Využitie fágov však nie je bez problémov. Niekedy môže ľudský imunitný systém fágovú aktivitu neutralizovať a niektorým fágom sa nedarí množiť v živočíšnych bunkách. Zatiaľ vieme veľmi málo o účinkovaní a dynamike liečiv na báze fágov v porovnaní s klasickými, preto by mala byť ich využitiu v boji s rezistentnými infekciami venovaná veľká experimentálna pozornosť.
Ak chcete mať prístup aj k exkluzívnemu obsahu pre predplatiteľov alebo si objednať tlačenú verziu časopisu Quark, prihláste sa alebo zaregistrujte.
RNDr. Jana Halušková PhD.






