Desaťročia výskumu chémie a farmakológie lipidov spolu s výskumom v ďalších oblastiach umožnili vznik mRNA vakcín proti ochoreniu covid-19. Cielený transport účinnej zložky mRNA vakcín na určené miesto v organizme je možný vďaka ich ochrannému obaleniu v lipidových (tukových) nanočasticiach.
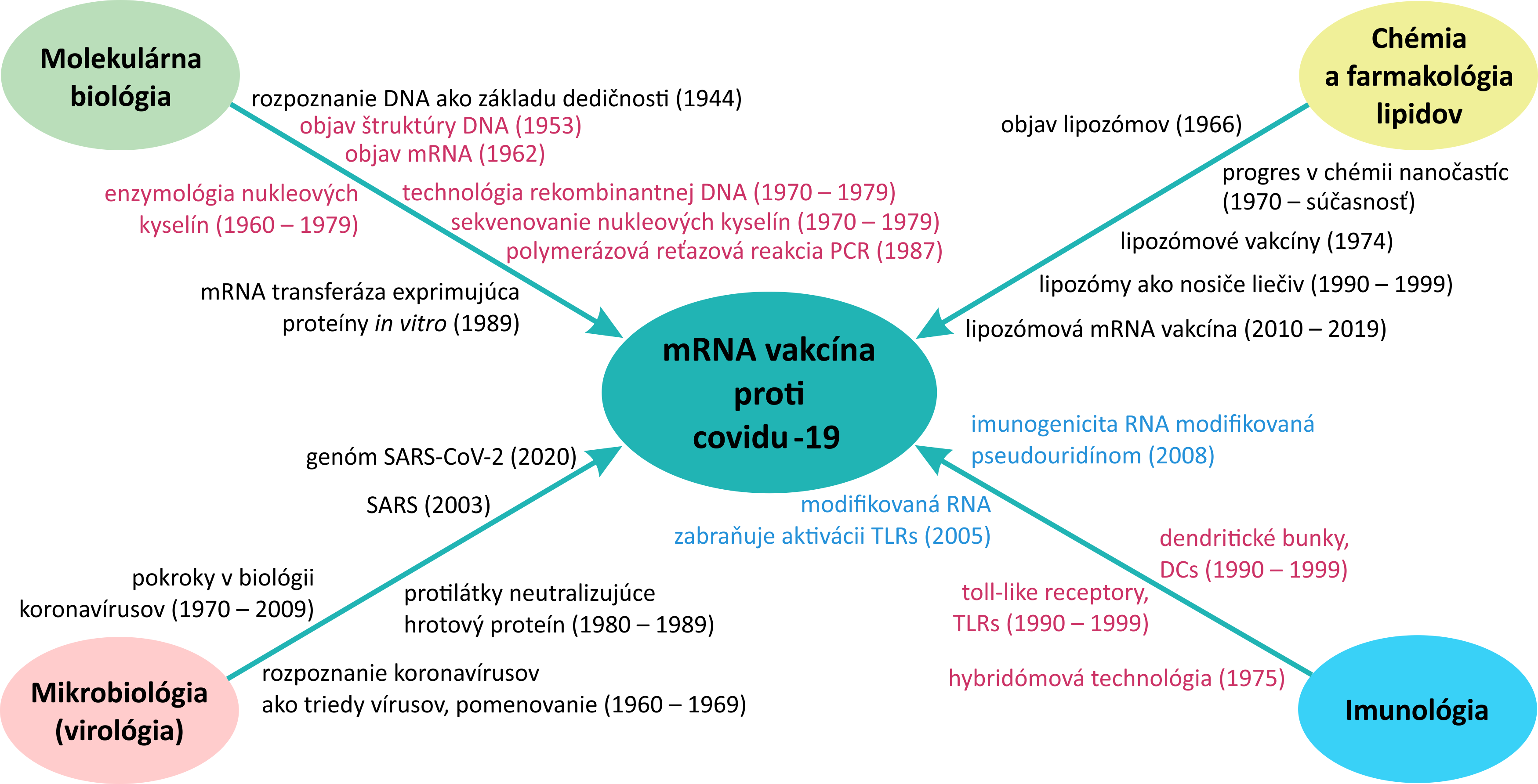
Vývoj technológií, vďaka ktorým sa mRNA vakcíny úspešne používajú, je dlhodobý. Medzi štyri najdôležitejšie oblasti výskumu, z ktorých každá zásadne prispela k vývoju mRNA vakcín, patria molekulárna biológia, chémia lipidov, mikrobiológia-virológia a imunológia. Vzniku mRNA vakcín predchádzali desaťročia intenzívneho výskumu, ktorého súčasťou boli mnohé vedecké objavy. Ich dôležitosť zdôrazňuje skutočnosť, že viaceré z objavov viedli k udeleniu Nobelových cien. Mediátorová ribonukleová kyselina, teda mRNA, bola objavená v roku 1961. Podľa štúdie Artura Casadevalla v časopise J. Clin. Invest. z roku 2021 sa vakcíny na báze mRNA ešte pred ich využitím proti ochoreniu covid-19 používali v predklinických a klinických skúškach pre viaceré infekčné choroby ako chrípka, zika, HIV, ebola, besnota, horúčka chikungunya, malária, genitálny herpes, toxoplazmóza a ďalšie.
Priekopníci mRNA technológie
Vakcíny využívajúce mRNA obsahujú modifikovanú ribonukleovú kyselinu, v ktorej je v prípade vakcíny proti ochoreniu covid-19 zakódovaný pokyn pre bunky na produkciu hrotového proteínu (spike proteínu) koronavírusu. Proti tomuto proteínu sa po určitom čase vytvorí v organizme imunitná odpoveď. Zaočkovaný človek je potom pripravený výrazne lepšie odolávať koronavírusu, ako aj znižovať riziko šírenia vírusu do okolia.
V článku časopisu Nature z roku 2021 autor Elie Dolgin uvádza, že priekopníkmi s najvýznamnejším príspevkom k mRNA technológii využitej pri vývoji vakcíny proti covidu-19 sú spomedzi mnohých maďarská biochemička Katalin Karikó a americký imunológ Drew Weissman. Spoločne vyvinuli upravenú mRNA bez nežiaducich reakcií imunitného systému.
Asi najviac nedoceneným pre vznik mRNA vakcín je prínos z oblasti chémie a farmakológie lipidov, a to najmä úspešný vývoj lipidových nanočastíc (Lipid Nano Particles, LNPs). LNPs umožňujú ochranu mRNA a jej presné doručenie k cieľovým bunkám v organizme. Priekopníkom tejto technológie je kanadský biochemik Pieter Cullis, ktorý ako prvý zaviedol do praxe použitie lipidových nanočastíc prenášajúcich RNA do buniek.
Prelomový krok – imobilizácia
Imobilizácia metódou tzv. enkapsulácie molekuly mRNA do LNPs bola zásadným prelomovým krokom. Bez tejto metódy by vakcína nebola funkčná. LNPs chránia nestabilnú makromolekulu mRNA pred predčasným rozpadom spôsobeným napríklad enzýmami. Môžu zároveň až tisícnásobne zvyšovať využiteľnosť mRNA bunkami organizmu v porovnaní s voľnou mRNA. LNPs tiež nahrádzajú funkciu nosiča aktívnej zložky v porovnaní s ďalšími typmi vakcín. Príkladom sú vektorové vakcíny, kde je nosičom neškodný vírus. Enkapsulácia mRNA v LNPs je aj kľúčovou súčasťou výroby vakcín. Americký úrad pre kontrolu potravín a liečiv (Food and Drug Administration, FDA) prvýkrát schválil používanie LNPs ako nosiča liečiv (na báze RNA) v roku 2018.
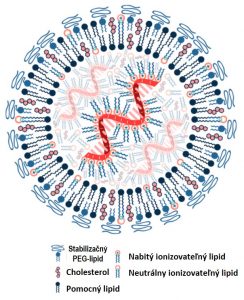
Zloženie nanočastíc…
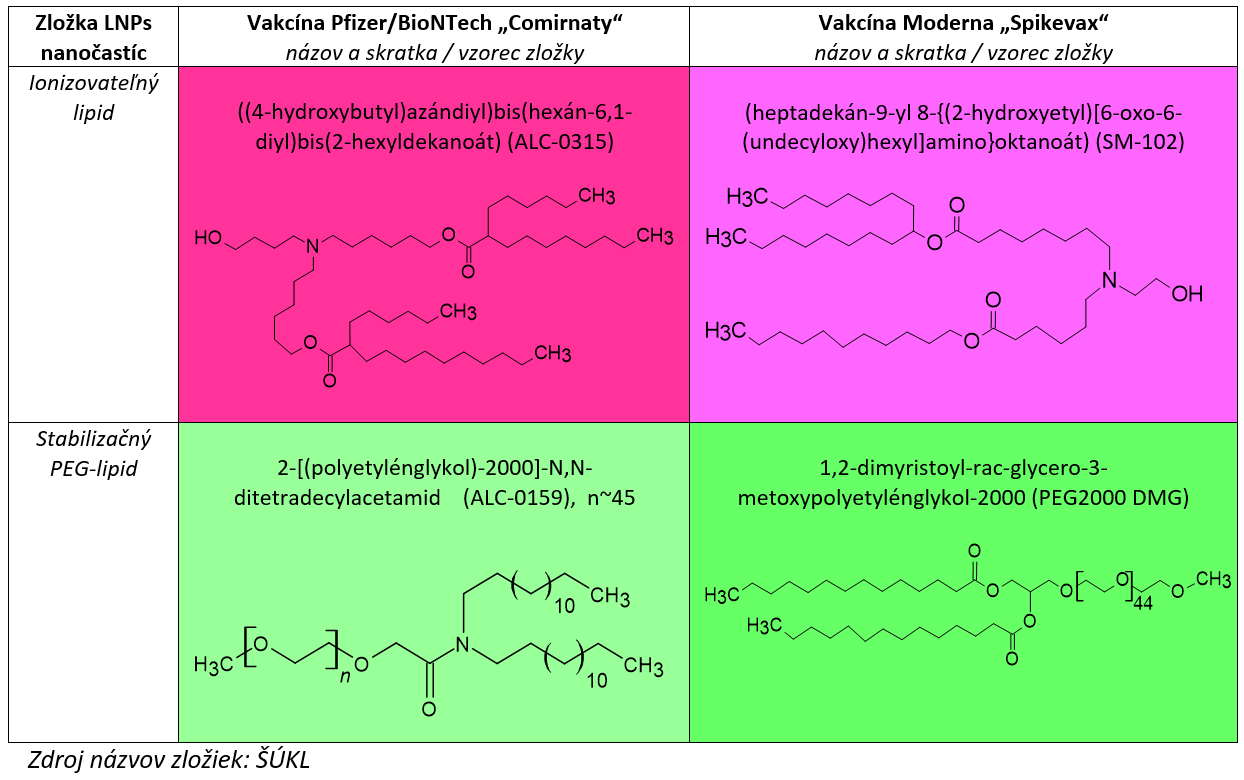
V prípade dvoch mRNA vakcín (Comirnaty od firmy Pfizer/BioNTech a Spikevax od Moderny) schválených Európskou liekovou agentúrou (EMA) sa lipidové nanočastice skladajú zo štyroch zložiek a mRNA.
Jednou z nich je tzv. ionizovateľný lipid v elektricky nabitej aj neutrálnej forme, ktorý má charakter polyelektrolytu. Ide o skupinu polymérov s nábojom, ktoré boli samostatne testované ako nosiče mRNA ešte predtým, ako sa presadili na tento účel LNPs. Ionizovateľný lipid s kladným nábojom elektrostaticky viaže negatívne nabitú mRNA a chráni ju vnútri LNPs. Umožňuje vytvorenie lipidovej dvojvrstvy a svojimi vlastnosťami pomáha uvoľniť mRNA z nanočastice presne na miesto určenia v hostiteľskej bunke.
Ďalšia zložka, tzv. stabilizačný lipid s viazaným polyetylénglykolom (PEG-lipid), tvorí povrch LNPs. Je potrebný spolu s ďalším, tzv. pomocným lipidom, na tvorbu lipidovej dvojvrstvy LNPs. Stabilizačný PEG-lipid a pomocný lipid spolu tvoria a stabilizujú štruktúru LNPs. PEG-lipid zároveň na povrchu zabraňuje viazaniu nežiaducich komponentov z okolia aj agregácii LNPs navzájom.
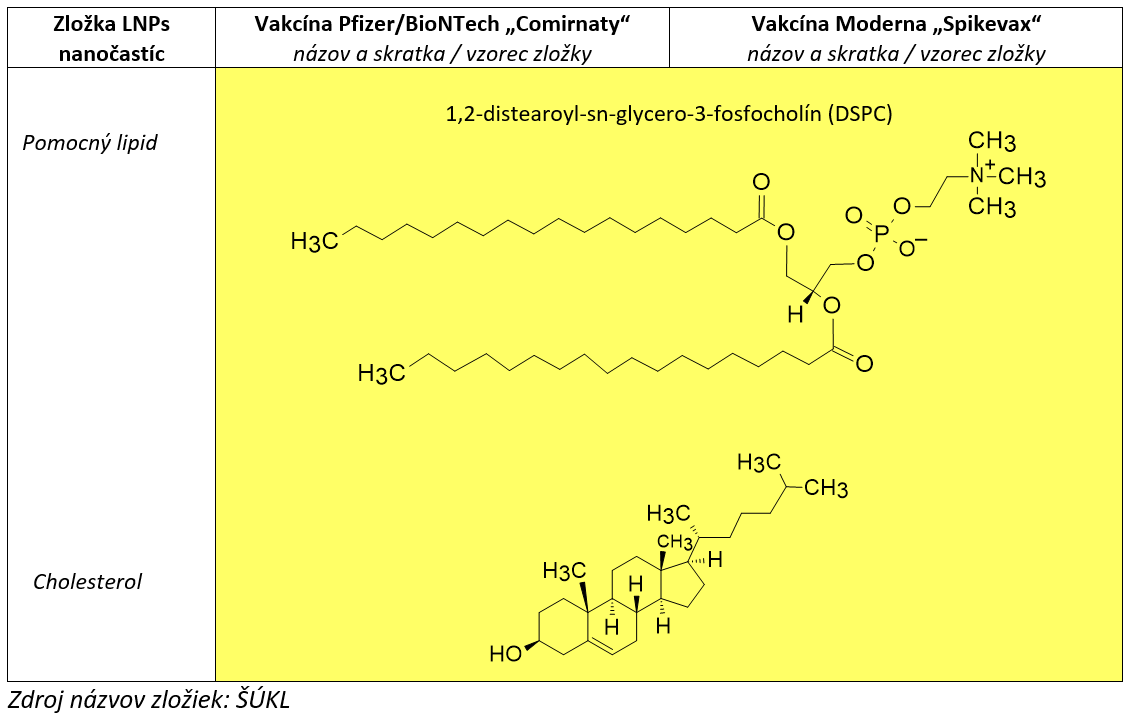
Poslednou zložkou LNPs je cholesterol, ktorý má viaceré funkcie. Tvorí výplň nanočastíc a umožňuje prenos mRNA cez membrány cieľových buniek.
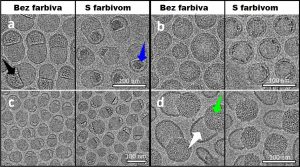
… a ich vzhľad
Častice mRNA vakcín sú v médiách kvôli názornosti označované ako tukové (lipidové) kvapôčky (vankúšiky). V skutočnosti ide o guľovité nanočastice zložené z už uvedených komponentov. Dôležitým parametrom z hľadiska ich účinnosti je ich veľkosť, ktorá je podľa pozorovaní Marianny Yanez Artetaovej a jej kolegov (PNAS 2018) v rozmedzí približne 50 až 100 nanometrov. Viditeľné sú až zobrazením v špeciálnom mikroskope, napríklad tzv. transmisnom elektrónovom mikroskope (TEM) pri 20- až 30-tisícnásobnom zväčšení. Kolektív vedcov pod vedením Marka L. Bradera dokázal prítomnosť mRNA v LNPs jej zviditeľnením pomocou farbiva tionínu (Biophys. J. 2021).
Výroba
Súčasné metódy výroby lipidových nanočastíc s mRNA využívajú podľa profesora Michaela Buschmanna (Vaccines, 2021) mikrofluidné systémy alebo miešanie v zariadeniach vybavených tzv. trojkanálovým mixérom (T-junction mixing). V nich dochádza k rýchlemu zmiešaniu roztoku nevodnej fázy etanolu a vodnej fázy. Nevodná fáza obsahuje hydrofóbne lipidy a vodná fáza mRNA v kyslom roztoku napríklad z kyseliny octovej. Všetky zložky častíc sa na základe ich pomerov a rýchlosti zmiešavania pri zvyšujúcej sa polarite a pH rozpúšťadla usporiadavajú do štruktúr s presným tvarom a veľkosťou.
Uvedené mikrofluidné systémy sú vhodné na prípravu laboratórnych množstiev častíc. Na výrobu priemyselných množstiev LNPs sa používajú veľkokapacitné tzv. T-mixéry. Pandémia covidu-19 a potreba výroby enormného množstva vakcín v krátkom čase kládla extrémne požiadavky na veľkovýrobu LNPs, na ktoré nemohli byť ani výrobcovia vopred pripravení. Dôsledkom bol napríklad aj mediálne sledovaný dočasný výpadok dodávok jedného z lipidových komponentov LNPs. Uvedené skutočnosti sú dôkazom, že prenos technológie z laboratórnej na priemyselnú úroveň nie je jednoduchý proces.
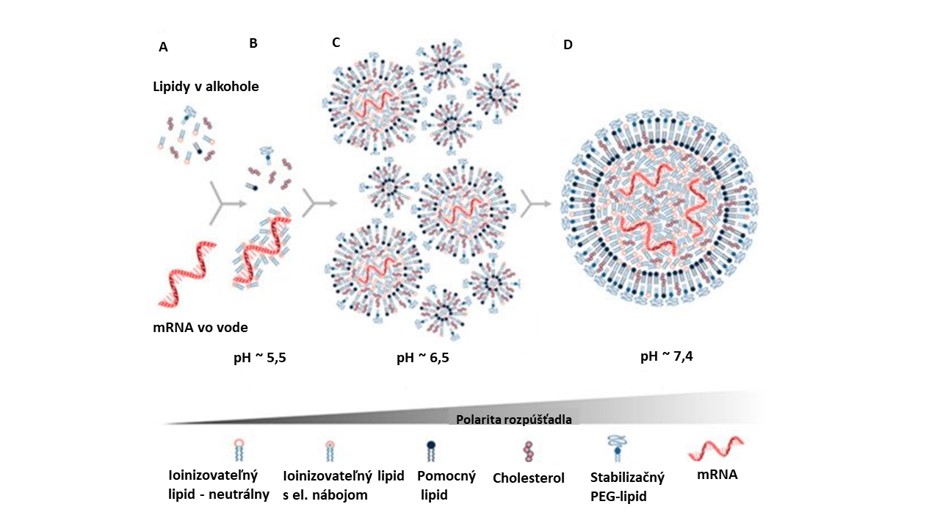
Sledované parametre
Je dôležité si uvedomiť, že na vývoji LNPs, ešte predtým ako boli optimalizované pre mRNA vakcíny, pracovali dlhodobo stovky až tisíce odborníkov. Zložky schválených LNPs nanočastíc mRNA vakcín sa starostlivo posudzovali v rámci hodnotiacich správ Európskej liekovej agentúry. Okrem dvoch nových lipidov – ionizovateľného a PEG-lipidu – boli zvyšné dve zložky LNPs úspešne otestované v inom, už schválenom produkte. Ionizovateľný lipid aj PEG-lipid sa testovali z hľadiska chemickej čistoty, kvality výroby aj stability počas skladovania. Sledovala sa ich farmakokinetika, metabolizmus, vylučovanie a ďalšie parametre. Na toxikologické štúdie vedci používali celé LNPs-mRNA nanočastice.
Medzi ďalšie dôležité parametre nanočastíc v prípade mRNA vakcín patria napríklad veľkosť dávky, efektivita jej dodania k cieľovým bunkám, prenos do buniek, vplyvy povrchového náboja LNPs a schopnosť nanočastíc aktivovať imunitnú odpoveď. Sledujú sa taktiež reakcie v mieste vpichu, bezpečnosť, tolerovateľnosť, reaktogenicita a iné.
Potrebné množstvo a skladovanie
Celková potrebná dávka lipidov ako zložiek LNPs nanočastíc mRNA vakcín je veľmi nízka. Napríklad množstvo PEG-lipidu v jednej dávke vakcíny Comirnaty predstavuje 50 μg. Zložky LNPs sa postupne metabolizujú a vylučujú z tela. Navyše, v prípade vakcíny Comirnaty (Pfizer-BioNtech) je účinná dávka lipidov v podanej vakcíne 300- až 1 000-krát menšia ako dávka potrebná na štúdium ich prípadnej toxicity. To takmer vylučuje, aby sa lipidy LNPs častíc akumulovali v tele napríklad po podaní posilňujúcich dávok (tzv. booster dávok).
Rozdiel v štruktúrach ionizovateľného lipidu a stabilizačného PEG-lipidu medzi porovnávanými vakcínami je zrejmý. Zvyšné dve zložky – pomocný lipid a cholesterol – sa používajú v oboch vakcínach rovnaké. Kvôli stabilizácii mRNA, ochrane častíc pred mrazom (kryoprotekcia) pri skladovaní, udržaniu hodnoty pH a osmotického tlaku sa tiež LNPs-mRNA nanočastice vakcín skladujú v špeciálnych roztokoch s obsahom neškodných prídavných látok, tzv. excipientov. Lyofilizáciu ako spôsob stabilizácie mRNA v LNPs uvádza aj Linde Schonmakerová v článku časopisu Int. J. Pharm. z roku 2021.
Dôležitosť výskumov
Úspešné použitie bezpečných a účinných mRNA vakcín vo forme lipidových nanočastíc proti ochoreniu covid-19 spoločne s ostatnými schválenými vakcínami a ďalšími opatreniami pomohlo zachrániť a zachraňuje značnú časť ľudskej populácie. Je to mimoriadny úspech dlhodobého vedeckého výskumu založeného na multidisciplinárnom prístupe.
Technológia cieleného transportu s využitím imobilizácie v nanočasticiach je rozhodujúcim funkčným systémom súčasných mRNA vakcín. Bude sa nepochybne naďalej skúmať, vylepšovať a využívať aj pre ďalšie medicínske aplikácie. Cieľom tohto článku bolo poukázať na dôležitosť výskumu imobilizačných techník súvisiacich s vývojom najmodernejších vakcín založených na využití mRNA.
Ing. Marek Bučko, PhD.
Ing. Peter Gemeiner, DrSc.
Chemický ústav SAV v Bratislave
Táto práca bola podporená Agentúrou na podporu výskumu a vývoja na základe Zmluvy č. APVV-20-0272 a VEGA 2/0130/20.
Literatúra:
Buschmann, M.D.; Carrasco, M.J.; Alishetty, S.; Paige, M.; Alameh, M.G.; Weissman, D. Nanomaterial Delivery Systems for mRNA Vaccines. Vaccines 2021, 9, 65. https://doi.org/10.3390/vaccines9010065
Arteta, M.Y; Kjellman, T.; Bartesaghi, S.; Wallin, S.; Wu, X.; Kvist, A.J.; Dabkowska, A.; Székely, N.; Radulescu, A.; Bergenholtz, J.; Lindfors, L. Successful reprogramming of cellular protein production through mRNA delivered by functionalized lipid nanoparticles. PNAS 2018, 115, 15: E3351-E3360. https://doi.org/10.1073/pnas.1720542115
Schoenmaker, L.; Witzigmann, D.; Kulkarni, J.A.; Verbeke, R.; Kersten, G.; Jiskoot, W.; Crommelin, D.J.A. 2021. mRNA-lipid nanoparticle COVID-19 vaccines: Structure and stability. Int. J. Pharm. 2021, 601, 120586. https://doi.org/10.1016/j.ijpharm.2021.120586
Dolgin, E. The tangled history of mRNA vaccines. Nature 2021, 597, 318-324.
doi: https://doi.org/10.1038/d41586-021-02483-w
Casadevall, A. The mRNA vaccine revolution is the dividend from decades of basic science research. J. Clin. Invest. 2021, 131(19): e153721. https://doi.org/10.1172/JCI153721.
https://www.wired.co.uk/article/mrna-coronavirus-vaccine-pfizer-biontech
https://www.ema.europa.eu/en/documents/assessment-report/comirnaty-epar-public-assessment-report_en.pdf
https://www.ema.europa.eu/en/documents/assessment-report/spikevax-previously-covid-19-vaccine-moderna-epar-public-assessment-report_en.pdf
https://ec.europa.eu/info/live-work-travel-eu/coronavirus-response/safe-covid-19-vaccines-europeans/how-do-vaccines-work_sk#ako-okovacie-ltky-proti-ochoreniu-covid-19-psobia
Brader, M.L.; Williams, S.J.; Banks, J.M.; Hui, W.H.; Zhou, Z.H.; Jin, L. Encapsulation state of messenger RNA inside lipid nanoparticles. Biophys. J. 2021, 120, 2766–2770. https://doi.org/10.1016/j.bpj.2021.03.012
Bučko, M.; Gemeiner, P.; Schenkmayerová, A.; Krajčovič, T.; Rudroff, F.; Mihovilovič, M.D. Baeyer-Villiger oxidations: Biotechnological approach. Appl. Microbiol. Biotechnol. 2016, 100, 6585–6599. https://doi.org/10.1007/s00253-016-7670-x
Autori článku z Chemického ústavu SAV sa dlhodobo venujú vývoju imobilizovaných buniek a enzýmov ako bunkových tovární potrebných na produkciu prekurzorov biologicky aktívnych látok a potenciálnych liečiv biokatalytickými postupmi. Problematiku opisujú autori v článku časopisu Appl. Microbiol. Biotechnol. z roku 2016. Imobilizácia umožňuje stabilizáciu a opakované použitie buniek a enzýmov, čo vedie ku kontrolovanej premene východiskových látok na žiadané produkty s vyššou pridanou hodnotou a selektivitou ako aj zníženou záťažou na životné prostredie. Výskum prebieha v rámci viacstranných vedeckých projektov v spolupráci so špičkovými domácimi a zahraničnými partnermi a komerčnou sférou.






