Dve izomérne formy vody sa odlišujú svojou schopnosťou vstupovať do chemických reakcií.
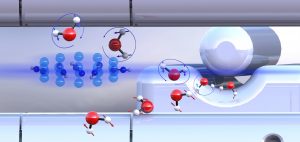
Pri využívaní vody – či už ju pijeme, umývame sa ňou alebo nám slúži pri príprave jedál – si asi málokedy uvedomujeme, že bez tejto jednoduchej zlúčeniny by sme neexistovali. Voda je podstatnou zložkou biosféry a tvorí približne 70 % nášho tela. Z chemického hľadiska ide v podstate o jednoduchú zlúčeninu – jej molekulu tvoria dva atómy vodíka a jeden atóm kyslíka. Máloktorý laik však vie, že voda nie je len jedna: chemici už dávnejšie vedia, že voda existuje v dvoch formách (izoméroch), ktoré sa odlišujú vzájomnou orientáciou jadrových spinov dvoch vodíkových atómov. V závislosti od toho, či sú tieto spiny orientované paralelne alebo proti sebe, hovoríme o ortovode a paravode. Výskumný tím profesora Stefana Willitscha z katedry chémie na univerzite v švajčiarskom meste Bazilej urobil nedávno významný objav. Zistil, že spomenuté dve izomérne formy vody sa odlišujú svojou reaktivitou, teda schopnosťou vstupovať do chemických reakcií. Predpokladom tohto objavu bolo separovanie dvoch foriem vody, čo bol vzhľadom na v podstate rovnaké fyzikálne vlastnosti oboch izomérov náročný proces. Ten vedci zvládli pomocou novej metódy, využívajúcej elektrické polia na báze voľných elektrónov. Výskum dvoch separovaných foriem vody ukázal, že paravoda reaguje v chemických reakciách asi o 25 % rýchlejšie než ortovoda. Tento rozdiel možno vysvetliť tým, že jadrové spiny ovplyvňujú aj rotáciu molekúl vody. To sa prejaví tak, že medzi zložkami vstupujúcimi do reakcie pôsobia rôzne príťažlivé sily. Paravoda je schopná v procese reakcie priťahovať iné zložky intenzívnejšie (môžeme povedať silnejšie) než ortovoda, má teda väčšiu chemickú reaktivitu. Experimenty sa uskutočnili s molekulami ochladenými na veľmi nízku teplotu (blízko absolútnej nuly).
Ilustrácia University of Basel
Ak chcete mať prístup aj k exkluzívnemu obsahu pre predplatiteľov alebo si objednať tlačenú verziu časopisu Quark, prihláste sa alebo zaregistrujte.






