Ústrednou témou slovenskej ľudovej rozprávky Soľ nad zlato je rozdielny názor jej aktérov na hodnotu soli. Väčšina z nich tvrdila, že zlato je cennejšie ako soľ. No šťastné rozuzlenie zápletky spočívalo nakoniec v uznaní, že tak ako pri všetkom, jej cena závisí od toho, či ju máme, alebo nemáme, resp. či jej máme dostatok, alebo nedostatok.

Kým v rozprávke sa k tomuto záveru dopracovali všetci milovníci zlata až potom, keď už jedlá bez soli nemohli vidieť ani cítiť, v skutočnosti by bez soli boli už dávno po smrti. V tomto prípade je soľ nepochybne cennejšia ako zlato, pretože zlato v mobiloch, elektronike a šperkoch je síce nenahraditeľné, ale bez soli v strave by nám tieto vymoženosti boli nanič.
Samozrejme, súčasná predajná cena zlata je oveľa vyššia ako cena soli, čo súvisí s tým, že zdroje soli ako suroviny sú veľké a zároveň sú náklady na jej získavanie a transport do miest s jej nedostatkom nízke. V minulosti bola práve cena poslednej položky vysoká a často posúvala cenu soli do závratných výšok. Spomeňme si napríklad iba na prevoz soli na chrbtoch tiav cez saharskú púšť. Keby sme však chceli soľ hodnotiť podľa rozsahu súčasnej ťažby, zlato jej nemôže konkurovať. Iba na porovnanie, ročná ťažba soli predstavuje približne 300 miliónov ton, kým pri zlate sú to necelé štyri tony. To je takmer 100-miliónkrát menej.
Soľ a halit

Slovo soľ má viac významov. Najčastejšie sa používa na pomenovanie slanej zrnitej látky predávanej ako prídavok do potravín. V obchodných baleniach môže mať prívlastok kuchynská, jedlá, vákuová, morská alebo jódovaná. Vo všetkých týchto prípadoch ide o zmes rôznych látok. Hlavnú však tvorí zomletý a preosiaty minerál halit.
Názov soľ má aj všeobecnejší význam. V chémii označuje skupinu látok s určitým charakteristickým zložením, ktoré možno pripraviť napríklad reakciou kyselín a zásad. Jednou z nich je práve chlorid sodný (NaCl), teda tá látka, ktorá je hlavnou zložkou našej potravinárskej soli. Zvláštne je, že jej triviálne názvy sú jedlá alebo kuchynská soľ, prípadne iba soľ, teda také isté ako obchodné názvy potravinárskej soli. Vo všetkých prípadoch však ide o rozdielne látky: kým v prvom je to čistý chlorid sodný, v druhom je to zmes látok s vysokým obsahom chloridu sodného. Aby sme sa neodchyľovali od našej témy, ako príklad iných solí uveďme práve tie, ktoré sú častou súčasťou primárnych surovín jedlej soli. Sú to napríklad síran horečnatý, síran vápenatý, chlorid draselný alebo chlorid horečnatý. Líšia sa rôznymi vlastnosťami vrátane rozpustnosti vo vode, ktorá sa môže meniť od veľmi slabej až po veľmi veľkú. Iným príkladom môže byť fluorid vápenatý (CaF2), ktorý je po NaCl druhým najrozšírenejším halogenidom na Zemi v podobe minerálu fluorit. Ten je však vo vode nerozpustný, takže nie je vodou splachovaný do morí tak ako halit.

V zátvorke za názvom halitu, ktorý je odvodený od gréckeho označenia mora (halos), je v mineralogických atlasoch uvedený vzorec chloridu sodného. No už z variability sfarbenia tohto mäkkého minerálu, ktorý môže byť bezfarebný, biely, žltkastý, modrastý, ružový či dokonca červený, je jasné, že okrem chloridu sodného môže obsahovať aj iné látky buď v podobe iných mikrokryštalických minerálov, alebo prvkov zabudovaných priamo v kubickej kryštálovej mriežke chloridu sodného. Tie môžu spôsobovať zelenú, ružovkastú či červenkastú fluorescenciu.
Chlorid sodný
Týmto názvom zvyčajne označujeme bielu kryštalickú látku. Ide o jednu z mála chemikálií, ktoré sa takmer výlučne získavajú izoláciou z jej prírodných zdrojov a nie chemickou cestou. Vo vode je dobre rozpustná, pričom jej rozpustnosť sa so zvyšovaním teploty mení pomerne málo. Je to iónová zlúčenina tvorená katiónmi sodíka a aniónmi chlóru, ktoré sú vo vodných roztokoch v hydratovanej forme. Všeobecnou vlastnosťou takýchto zlúčenín je vysoká teplota topenia a teplota varu. V prípade NaCl je to približne 800 °C a 1 400 °C. V pevnom skupenstve sú tieto zlúčeniny zlými vodičmi prúdu, ich taveniny a vodné roztoky sú, naopak, dobrými.

Je zaujímavé, že chlorid sodný, látka, bez ktorej by sme neprežili, je tvorená dvomi prvkami, z nich každý sám osebe je mimoriadne nebezpečný. Prvý je mäkký kov, s ktorým väčšina z nás nikdy neprišla do styku. Jeho riziká vyplývajú z toho, že s vodou reaguje silne exotermickou reakciou. Pri nej sa tvorí známa žieravina hydroxid sodný a vodík, ktorý sa vznikajúcim teplom vo vzduchu zapáli alebo vybuchne. Chlór je toxický plyn s dvojatómovými molekulami Cl2, ktorý sa v prvej svetovej vojne používal ako bojová otravná látka.
Odkiaľ sa vzala
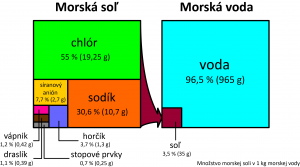
Asi 80 % všetkej soli na Zemi je sústredených v približne 3,5-percentnom vodnom roztoku morí a oceánov. Zvyšok nájdeme v podobe halitu v ložiskách kamennej soli na pevnine. Určujúcim pre množstvo tejto látky v zemskej kôre je obsah chlóru, ktorého je výrazne menej ako sodíka. Na jeden atóm chlóru tam pripadá približne 150 atómov sodíka.

Do morí a oceánov sa soľ dostáva vodnými tokmi jednak ako jeden z produktov zvetrávania hornín, jednak aj rozpúšťaním rôznych kumulácií halitu. Niektoré naše minerálky k tomu tiež prispievajú. Ďalším zdrojom je podmorská vulkanická činnosť a rozpúšťanie morských sedimentov. Veľká časť vyťaženej kamennej soli sa po jej použití tiež vracia do oceánov a morí. Pevninské ložiská kamennej soli vznikli často odparením morských vôd, prípadne aj slaných jazier. Pod povrch zeme sa dostali počas rôznych geologických procesov.
Morská alebo kamenná
Morskou soľou sa chápe soľ získaná odparovaním morskej vody, no aj kamenná soľ je zvyčajne niekdajšou morskou soľou. Na prvý pohľad by mali byť teda približne rovnaké. Väčšinou to tak však nie je. Dôvod je ten, že kým zloženie hlavnej časti morských a oceánskych vôd sa mení vďaka premiešavaniu morskými prúdmi pomerne málo, čistota ložísk kamennej soli závisí od miery ich kontaminácie počas geologických procesov. Tá môže byť veľmi vysoká alebo aj veľmi nízka. No aj v prípade pomerne nízkej čistoty kamennej soli ju možno použiť, ak sa ťaží vháňaním vody do ložiska a následný slaný roztok sa odparí. Tým sa zbaví väčšiny vo vode nerozpustných prímesí. V súčasnosti sa na to väčšinou používa technológia odparovania za zníženého tlaku, pri ktorej stačí, aby sa soľanka zahriala na necelých 38 °C.

Na prvý pohľad sa zdá, že najvýhodnejší spôsob, ako sa dostať k soli, je odparením morskej vody na slnku. Minimálne preto, že na to nepotrebujeme drahú energiu. Je tu však viacero komplikácií, ktoré to vo väčšine pobrežných oblastí znemožňujú. Hlavná súvisí s hygroskopickými vlastnosťami NaCl, ale aj iných prítomných solí. Preto získať soľ pri vysokej vlhkosti vzduchu možno iba v oblastiach s dlhodobými vysokými teplotami, v ktorých sa dajú vytvoriť plytké lagúny neohrozované vlnobitím. Zároveň by táto voda mala byť čo najčistejšia, no aj v tomto prípade bude soľ vždy obsahovať rôzne anorganické a organické nečistoty vrátane nerozpustných častíc a mŕtvych mikroorganizmov. Z hľadiska zbavenia sa nerozpustných prímesí je predsa len vákuové odparovanie soľanky z kamennej, prípadne aj morskej soli efektívnejšie.
Prídavné látky
Na rozdiel od väčšiny potravinárskych výrobkov v kuchynskej soli mnoho prídavných látok nenájdeme. Zvyčajne ide o tri skupiny týchto látok, no iba jedna z nich je tam takmer vždy. Sú to protihrudkujúce látky, ktoré zabraňujú spájaniu sa malých zrniek soli do väčších tvrdých hrudiek. Tie sťažujú presné dávkovanie soli a jej rovnomerné rozptýlenie v potravinách. Tvorba hrudiek soli je dôsledkom jej hygroskopických vlastností. Protihrudkujúce látky vytvárajú na časticiach soli obal, ktorý čiastočne obmedzuje pohlcovanie vodných pár zo vzduchu. Túto funkciu zvyčajne plní kremičitan vápenatý.
Ďalším prídavkom je fluorid sodný, ktorý sa ukázal ako jeden z účinných spôsobov ochrany pred zubným kazom. Súvisí to s tým, že fluór je stavebným prvkom fluórapatitu v zubnej sklovine. História tejto metódy sa začala v roku 1950 vo Švajčiarsku, kde 80 % jedlej soli má doteraz prídavok tejto látky. Vysoké koncentrácie fluóru však majú opačný účinok, o čom sme sa mohli presvedčiť aj u nás v okolí Žiaru nad Hronom. Tunajší závod na výrobu hliníka dlhé roky ničil svoje okolie exhalátmi obsahujúcimi tento prvok.
 Historický Solivar
Historický Solivar
Jediným miestom na území súčasného Slovenska, kde sa ťažila a spracovávala kamenná soľ, bol Solivar, teraz mestská časť Prešova. Táto história sa začala v roku 1572 tradičným hlbinným dobývaním kamennej soli. Po zatopení baní sa prešlo v roku 1752 na metódu odparovania soľanky, ktorá sa na povrch dopravovala vo veľkých kožených vakoch. V roku 1946 došlo k zásadnej modernizácii ťažby a spracovania soľanky z vrtov, ktorá sa už na povrch čerpala potrubiami. Produkcia soli sa skončila v roku 2009, teda po 439 rokoch. Ložiská soli v okolí Prešova a Zbudze sú pozostatkom dávneho mora.
Keď chýba jód

Vždy, keď zbadáme na obale jedlej soli nápis jódovaná soľ, mali by sme spozornieť. Nebojte sa, nič nám nehrozí. Dôvod našej pozornosti by mal byť úplne iný. Látky ako jodid draselný (KI) alebo jodičnan draselný (KIO3) zabezpečujú pre naše telo nevyhnutný príjem jódu. Zároveň by však mohli popri očkovaní slúžiť aj ako trvalý pomník druhej najväčšej zdravotníckej revolúcie v histórii Slovenska.
Aby sme tomu rozumeli, predstavme si teraz už nepredstaviteľné – a to, že v slovenských mestách a dedinách sme na každom kroku stretávali ľudí s neuveriteľne opuchnutým hrdlom, evidentným mentálnym postihnutím a rôznymi závažnými zdravotnými problémami. To bola skutočne realita v období, keď sme sa niektorých ťažkých chorôb na Slovensku zbavili už očkovaním, teda začiatkom druhej polovice minulého storočia.
Skúsme si priblížiť skutočný rozsah choroby, ktorú primárne spôsoboval nedostatok jódu v pôde a pitnej vode. Bol to problém mnohých vnútrozemských krajín, pretože väčšina jódu na Zemi je sústredená v moriach a oceánoch. Opuch hrdla spôsobený chorobným zväčšením štítnej žľazy (struma) postihoval celé Slovensko, no v troch najviac postihnutých oblastiach dosahoval katastrofálne rozmery. Bola to oblasť Štiavnických vrchov a Slovenského rudohoria, Žitného ostrova a severozápadného Slovenska (Orava, Kysuce, Biele Karpaty). Strumu tam malo približne 65 % detí do desať rokov, asi 80 % dospelých žien a 45 % mužov. Endemický kreténizmus tam postihoval 3 % obyvateľstva a slabomyseľnosť a znížený intelekt ešte viac.

Optimálny príjem
Tieto hrôzostrašné čísla pochádzajú z prieskumu, ktorý urobil v rokoch 1949 až 1953 slovenský endokrinológ doc. MUDr. Julián Podoba, CSc., so svojím kolektívom lekárov a chemikov vyšetrením približne 160 000 obyvateľov Slovenska. Situácia sa začala dramaticky zlepšovať práve prídavkom jódu do soli.
Prečo práve do soli? Lebo bez ohľadu na to, či sa držíme odporúčaných denných dávok soli, nikdy soľ zo stravy nevylučujeme a zároveň ju nikdy neprekračujeme takým výrazným spôsobom ako pri iných zložkách potravín, napríklad cukre. Nehrozí teda jej nedostatok a ani predávkovanie.
Príčinou nedostatku jódu v strave bolo v minulosti to, že značná časť obyvateľstva bola odkázaná na domáce zdroje potravín. V súčasnosti sa vďaka globálnemu obchodu s potravinami situácia zásadne zmenila. Otázkou tak je, či je neustále potrebné do soli pridávať jód. Napriek obrovskému výberu potravín je však strava časti obyvateľov jednostranná. Preto je istejšie zabezpečiť si príjem tohto prvku práve v jedlej soli.
Široké použitie
Dve hlavné oblasti použitia soli nájdeme v potravinárskom priemysle. Prvou je výroba potravín, druhou ich konzervovanie. Lekármi odporúčaný denný príjem soli sa pohybuje v určitom intervale a jeho dlhodobé prekračovanie vedie k rôznym zdravotným komplikáciám, napríklad hypertenzii. Pri používaní jedlej soli v domácnostiach je preto potrebné si uvedomiť, že väčšina potravín a potravinárskych polotovarov už obsahuje pomerne veľké dávky soli. Konzervácia potravín, predovšetkým mäsa vrátane rýb, je založená na osmotickej dehydratácii živočíšnych tkanív a zároveň aj buniek väčšiny mikroorganizmov. Iný spôsob je chladenie najmä čerstvo ulovených rýb zmesou ľadu a soli, ktorou možno dosiahnuť teploty výrazne pod 0 °C.

Mimoriadne významným použitím soli nižšej kvality sú zimné posypy, ktoré buď zabraňujú vytvoreniu ľadových a snehových vrstiev na chodníkoch, alebo ich roztápajú. Tento efekt je dôsledkom vplyvu NaCl na teplotu mrznutia vody. Tú môže znížiť až na −21,1 °C, čo sa však dá dosiahnuť iba pri vysokej koncentrácii soli. Práve tento príklad ilustruje, že prítomnosť chloridu sodného vo vode môže výrazne meniť jej vlastnosti, napríklad aj teplotu varu alebo hustotu.
NaCl je tiež hlavným zdrojom na výrobu sodíka a chlóru a mnohých chemikálií obsahujúcich tieto prvky. Je to napríklad kyselina chlorovodíková (HCl) alebo hydrogénuhličitan sodný (NaHCO3), bežne označovaný ako sóda bikarbóna, ktorá je zložkou potravinárskych kypriacich práškov, šumivých tabliet a rôznych čistiacich práškov. NaCl má široké použitie aj v sklárskom a papierenskom priemysle, pri výrobe mydla, pracích práškov a detergentov.
Text a foto prof. Ing. Karol Jesenák, CSc.






