Voda je jednou z najrozšírenejších substancií v ekosystémoch. Čistá voda je bezfarebná tekutina bez vône a chuti. Napriek tomu má prekvapujúce vlastnosti, preto sa často označuje za neobyčajnú či anomálnu látku. Prečo je to tak?
 Voda je jedinou látkou, ktorá sa v prírode môže vyskytnúť vo všetkých troch skupenstvách súčasne: v pevnom skupenstve ako ľad, v kvapalnom ako kvapalina a v plynnom ako vodná para. Je súčasťou každej živej organickej látky a nevyhnutnou zložkou tvorby biomasy a organizmov. V procese tvorby biomasy je súčasťou procesu fotosyntézy, t. j. tvorby organických látok z látok anorganických. Živé organizmy, teda aj človek, môžu existovať len vtedy, keď sú dostatočne hydratované, teda obsahujú dostatok vody pre správnu funkciu svojich orgánov.
Voda je jedinou látkou, ktorá sa v prírode môže vyskytnúť vo všetkých troch skupenstvách súčasne: v pevnom skupenstve ako ľad, v kvapalnom ako kvapalina a v plynnom ako vodná para. Je súčasťou každej živej organickej látky a nevyhnutnou zložkou tvorby biomasy a organizmov. V procese tvorby biomasy je súčasťou procesu fotosyntézy, t. j. tvorby organických látok z látok anorganických. Živé organizmy, teda aj človek, môžu existovať len vtedy, keď sú dostatočne hydratované, teda obsahujú dostatok vody pre správnu funkciu svojich orgánov.
Fotosyntetizujúce rastliny a ich plody obsahujú približne 90 % vody z celkovej hmotnosti rastliny, pri znížení obsahu vody v dôsledku sucha rastliny prestanú fotosyntetizovať a zvädnú.
Obsah vody v ľudskom tele sa pohybuje od 70 do 80 %, v tele starších ľudí je menej vody ako u mladších. Dokonca aj naše kosti obsahujú približne 15 % vody. Už 10 % strata vody výrazne znižuje schopnosť organizmu normálne fungovať, strata 20 % je pre človeka fatálna. Základné potraviny, ako je napríklad chlieb, obsahujú asi 50 % vody, maslo približne 20 %. Dostatok vody je teda nevyhnutnosťou pre správnu funkciu živých organizmov.
Prečo je taká neobyčajná?
 Molekulu vody tvoria dva atómy vodíka a jeden atóm kyslíka, spojené kovalentnou väzbou. Atómy vodíka sú naviazané na atóm kyslíka tak, že tvoria rovnoramenný trojuholník, na jeho vrchole je atóm kyslíka a na ostatných dvoch vrcholoch sú atómy vodíka. Medzi spojnicami atómov vodíka a kyslíka je uhol 105°, tvar molekuly vody sa podobá na písmeno v.
Molekulu vody tvoria dva atómy vodíka a jeden atóm kyslíka, spojené kovalentnou väzbou. Atómy vodíka sú naviazané na atóm kyslíka tak, že tvoria rovnoramenný trojuholník, na jeho vrchole je atóm kyslíka a na ostatných dvoch vrcholoch sú atómy vodíka. Medzi spojnicami atómov vodíka a kyslíka je uhol 105°, tvar molekuly vody sa podobá na písmeno v.
Molekula vody je usporiadaná tak, že ťažiská kladných nábojov nie sú totožné s ťažiskami záporných nábojov, a preto tvoria elektrický dipól. Molekula vody je teda polárna, čo má zásadný vplyv na vlastnosti vody a na vzájomnú afinitu jej molekúl, ako aj na afinitu molekúl vody k iným látkam. Okrem toho je molekula vody relatívne malá – jej dĺžka je 0,275 nm (0,275 × 10-6 mm), a preto na rozdiel od väčších molekúl rozpustených látok prechádza otvormi organických membrán.
Vodíkové mostíky a hydridy
Dipóly vody sa môžu sformovať do zhlukov tak, že sa navzájom priťahujú opačne nabité póly dipólov vody. Vytvárajú kváziusporiadanú štruktúru, ktorá má čiastočne vlastnosti tuhého telesa. Takáto štruktúra vody vyzerá tak, že sa v nej striedajú atómy vodíka a kyslíka.
Väzby medzi molekulami vody nie sú trvalé. Toto silové prepojenie sa nazýva vodíkový mostík. Existencia vodíkového mostíka mení vlastnosti vody a jej správanie sa výrazne líši od správania ostatných kvapalín.
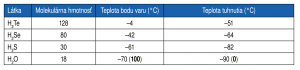
Existuje niekoľko látok so štruktúrou podobnou vode: sú to tzv. hydridy. Ide o zlúčeniny kyslíka (O), selénu (Se), telúru (Te) a síry (S) s dvomi atómami vodíka (H).
Napriek podobnosti štruktúry hydridov s vodou majú hydridy (H2Te, H2Se a H2S) niektoré vlastnosti diametrálne odlišné od vlastností vody. Teploty bodu varu a tuhnutia majú hlboko v oblasti záporných teplôt. Teplota varu vody, ako aj teplota jej tuhnutia by mali byť podľa jej štruktúry v oblasti negatívnych teplôt (sú uvedené v tabuľke). No pri normálnom tlaku je teplota bodu varu vody 100 °C a teplota bodu topenia 0 °C. Tieto rozdiely sú spôsobené existenciou vodíkových mostíkov vedúcich ku kváziusporiadanej štruktúre vody. Za normálnych podmienok (0 °C) by voda mala byť plynom. Voda je však výnimkou zo zákonitostí periodickej sústavy prvkov.
Hustota vody
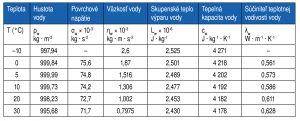
Hustota kvapalín sa s rastúcou teplotou znižuje. Výnimkou je voda, ktorej hustota sa s rastúcou teplotou od 0 až po 3,98 °C zvyšuje. Pri tejto teplote dosahuje maximálnu hustotu (ρw = 1 000 kg · m-3). Pri ďalšom zvyšovaní teploty sa voda správa normálne a jej hustota sa znižuje. Tento jav je jednou z viacerých anomálnych vlastností vody, má však veľký význam pre ekosystémy. Pri znižovaní teploty vody v dôsledku znižovania teploty vzduchu sa voda vertikálne rozdelí podľa hustoty, teda voda s najväčšou hustotou je v spodnej vrstve (to je voda s teplotou 4 °C). Chladnejšia voda zostáva na povrchu a pri ďalšom znižovaní teploty sa mení na ľad. Keďže ľad má nižšiu hustotu ako kvapalná voda, pláva na povrchu a chráni vodné teleso pred zamrznutím. Keby voda nemala závislosť medzi objemovou hmotnosťou a teplotou s minimom pri 4 °C, niektoré vodné telesá by zamrzli až na dno a zničili by tam všetok život.
Hustota ľadu je nižšia asi o 8 % ako hustota kvapalnej vody, preto ľad pláva na hladine a teplotne izoluje vodu pod ľadom. Napriek zaužívaným predstavám súčiniteľ tepelnej vodivosti ľadu (λi = 2,834 W · m-1 · K-1) je približne päťnásobok tepelnej vodivosti kvapalnej vody (λw = 0,6 W · m-1 · K-1), no aj tak ľadová vrstva pomáha teplotne izolovať vodu pod ľadom.
Medzi ďalšie dôsledky väčšieho merného objemu ľadu v porovnaní s vodou (objem jedného gramu ľadu s objemom jedného gramu kvapalnej vody) patrí intenzifikácia zvetrávania povrchových vrstiev Zeme. Voda v puklinách hornín pri mrznutí zväčšuje svoj objem a trhá horniny, čím výrazne urýchľuje zvetrávanie hornín a eróziu krajiny. Negatívnym následkom väčšieho objemu ľadu pri mrznutí vody je trhanie potrubí so zamrznutou vodou.
Povrchové napätie
Povrchové napätie vody je relatívne veľmi vysoké, čo je tiež dôsledok kváziusporiadanej štruktúry vody a súvisí s interakciami medzi molekulami vody prostredníctvom vodíkových mostíkov. Povrchové napätie vody je najväčšie z povrchových napätí všetkých známych kvapalín – jedine ortuť má povrchové napätie vyššie. Povrchové napätie vody pri teplote 20 °C je σw = 72,7 × 10-3 kg · s-3. Pri rovnakej teplote je povrchové napätie nafty σ = 26 × 10-3 kg · s-3 a povrchové napätie etylalkoholu σ = 22,7 × 10-3 kg · s-3.
 Voda zmáča povrch hydrofilných telies. Veľké povrchové napätie vody je príčinou, prečo sa vodné teleso snaží minimalizovať svoj objem a vytvára kvapky. Rovnako je spolu s kohéziou molekúl vody a adhéziou k látkam (zmáčavosťou) v okolí príčinou tzv. kapilárnych javov. Ak sa do vody ponorí sklená rúrka s priemerom menej ako 1 mm (nazýva sa kapilára), voda v nej vystúpi do výšky nepriamoúmernej priemeru rúrky. Tento jav má zásadnú dôležitosť v prírode: voda (spolu s rozpustenými živinami) vzlína v tenkých organických kapilárach v pôde a rastlinách. Kapilárne javy spôsobené vysokým povrchovým napätím vody v kombinácii so zmáčavosťou hydrofilných povrchov majú základný význam pri transporte vody z podzemných a pôdnych vôd cez pôdu ku koreňom rastlín. Voda (alebo roztok) môže teoreticky vystúpiť až do výšky 10 metrov nad hladinu podzemnej vody. Výstup vody (roztokov) do väčších výšok prebieha inými mechanizmami. Bez existencie vysokého povrchového napätia vody a hydrofilných organických a minerálnych látok (sú to takmer všetky pôdy a rastliny) by nebola možná produkcia biomasy.
Voda zmáča povrch hydrofilných telies. Veľké povrchové napätie vody je príčinou, prečo sa vodné teleso snaží minimalizovať svoj objem a vytvára kvapky. Rovnako je spolu s kohéziou molekúl vody a adhéziou k látkam (zmáčavosťou) v okolí príčinou tzv. kapilárnych javov. Ak sa do vody ponorí sklená rúrka s priemerom menej ako 1 mm (nazýva sa kapilára), voda v nej vystúpi do výšky nepriamoúmernej priemeru rúrky. Tento jav má zásadnú dôležitosť v prírode: voda (spolu s rozpustenými živinami) vzlína v tenkých organických kapilárach v pôde a rastlinách. Kapilárne javy spôsobené vysokým povrchovým napätím vody v kombinácii so zmáčavosťou hydrofilných povrchov majú základný význam pri transporte vody z podzemných a pôdnych vôd cez pôdu ku koreňom rastlín. Voda (alebo roztok) môže teoreticky vystúpiť až do výšky 10 metrov nad hladinu podzemnej vody. Výstup vody (roztokov) do väčších výšok prebieha inými mechanizmami. Bez existencie vysokého povrchového napätia vody a hydrofilných organických a minerálnych látok (sú to takmer všetky pôdy a rastliny) by nebola možná produkcia biomasy.
Viskozita (väzkosť)
Viskozita alebo väzkosť vyjadruje spolupôsobenie medzi vrstvami tekutín pohybujúcimi sa rozdielnymi rýchlosťami. Viskozita vody je jedna z mála fyzikálnych charakteristík vody, ktorá sa výrazne nelíši od viskozity podobných látok. Rýchlosť prúdenia vody v pôde je nepriamoúmerná viskozite kvapaliny (vody). Viskozita vody pri teplote 20 °C je η = 1 × 10-3 kg · m-1 · s-1. S teplotou klesá a pri teplote 50 °C je približne polovičná v porovnaní s viskozitou vody pri 20 °C.
Ing. Viliam Novák, DrSc.
Ústav hydrológie SAV, v. v. i., v Bratislave
Foto Pixabay



